
| 化学式 | CH3COOH | H2S | HClO |
| 电离常数 | 1.8×10-5 | K1:1.3×10-7,K2:7.3×10-15 | 3.2×10-8 |

| ||
| ||
| 6.4g |
| 64g/mol |
| ||
| 0.2mol |
| 0.2L |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铁可用作红色油漆和涂料 |
| B、金属镁可用于制造信号弹 |
| C、碳酸钠可用于治疗胃酸过多 |
| D、二氧化硅可用来制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 正、负极都是碳材料的双碳性电池,电池充、放电过程为2nC+LiA
正、负极都是碳材料的双碳性电池,电池充、放电过程为2nC+LiA | 充电 |
| 放电 |
| A、a是电池的负极 |
| B、放电时,A-离子向b极移动 |
| C、放电时,负极的电极反应式是nC-e-+A-=CnA |
| D、充电时,电解质中的离子浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.44g | B、3.2g |
| C、2.82g | D、4.36g |
查看答案和解析>>
科目:高中化学 来源: 题型:
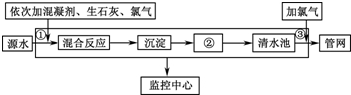
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤焦油、石油、花生油都属于烃 |
| B、蛋白质、脂肪、葡萄糖在一定条件下都能水解 |
| C、甲烷、乙烯、苯都可通过石油分馏得到 |
| D、乙醇既能与有机化合物反应又能与无机化合物反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com