
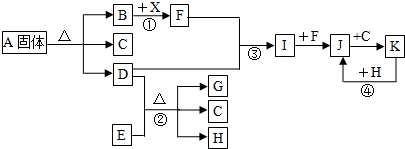
分析 常温下B、D、F、G、I、J是气体,F、G是空气中的主要成分,分别为氧气、氮气中的一种,D是一种碱性气体,则D为NH3,E是一种黑色氧化物,H是紫红色金属单质,结合转化关系②可知,E为CuO、H为Cu,G为N2、C为H2O,故F为O2,由F与D得到I、I能与F继续反应生成J,则I为NO、J为NO2,J与C(H2O)反应生成K,K与H(Cu)反应得到二氧化氮,则K为HNO3,固体A分解得到氨气、水与气体B,B能与X反应得到F(氧气),则B为CO2,X为Na2O2,A中阴、阳离子个数比是1:1,故A为NH4HCO3,据此解答.
解答 解:常温下B、D、F、G、I、J是气体,F、G是空气中的主要成分,分别为氧气、氮气中的一种,D是一种碱性气体,则D为NH3,E是一种黑色氧化物,H是紫红色金属单质,结合转化关系②可知,E为CuO、H为Cu,G为N2、C为H2O,故F为O2,由F与D得到I、I能与F继续反应生成J,则I为NO、J为NO2,J与C(H2O)反应生成K,K与H(Cu)反应得到二氧化氮,则K为HNO3,固体A分解得到氨气、水与气体B,B能与X反应得到F(氧气),则B为CO2,X为Na2O2,A中阴、阳离子个数比是1:1,故A为NH4HCO3,
(1)由上述分析可知,A为NH4HCO3,故答案为:NH4HCO3;
(2)反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)反应①为2CO2+2Na2O2=2Na2CO3+O2,产生标准状况下1.12L氧气,其物质的量=$\frac{1.12L}{22.4L/mol}$=0.06mol,反应中氧元素由-1价升高为氧气中0价,转移电子数为0.05mol×2×[0-(-1)]=0.1mol,注意电子数为6.02×1022,
故答案为:6.02×1022;
(4)反应②是氨气与CuO反应生成氮气、Cu与水,反应中CuO转化Cu元素化合价由+2降低为0价,故CuO是氧化剂,
故答案为:CuO.
点评 本题考查无机物推断,涉及氮元素化合物性质与转化,物质的颜色及特殊性质是推断突破口,注意根据氧化还原反应理解反应②,难度中等.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的NaCl溶液是指此溶液中含有1 mol NaCl | |
| B. | 从1L 0.5mo1/L的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.1mol/L | |
| C. | 0℃时,1molC12的体积约为22.4L | |
| D. | 1mol/L的CaCl2溶液中,Cl-的物质的量浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
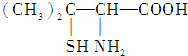
| A. | 青霉氨基酸分子中所有碳原子均在同一直线上 | |
| B. | 青霉氨基酸具有两性并能发生酯化反应 | |
| C. | 青霉氨基酸分子间不能发生缩合反应 | |
| D. | 1 mol青霉氨基酸与足量的金属钠反应生成0.5 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23g NO2和N2O4的混合气体含有NA个氧原子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制氧气时,用Na2O2或H2O2作反应物应该选择不同的气体发生装置 | |
| B. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀时的离子方程式为:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2用作呼吸面具的供氧剂 | B. | 工业上电解熔融状态Al2O3制备Al | ||
| C. | 工业上利用合成氨实现人工固氮 | D. | 实验室用NH4Cl 和Ca(OH)2制备NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com