
| A. | 甲烷的比例模型: | B. | 氯离子的结构示意图: | ||
| C. | 氮气分子的结构式:N≡N | D. | 过氧化钠的电子式: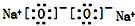 |
分析 A.比例模型能够体现出分子的空间结构及各原子相对体积大小,据此判断甲烷的比例模型;
B.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构;
C.用短线“-”代替共用电子对即为结构式,结构式只把共用电子对用短线表示,未成键的电子不画出;
D.过氧化钠为离子化合物,过氧根离子的表示方法错误.
解答 解:A.甲烷为正四面体结构,碳原子半径大于氢原子,则甲烷的比例模型为: ,故A正确;
,故A正确;
B.氯离子的核电荷数为17,核外电子总数为18,则氯离子正确的结构示意图为: ,故B正确;
,故B正确;
C.N原子之间形成三对共用电子对,结构式只把共用电子对用短线表示,未成键的电子不画出,N2的结构式为N≡N,故C正确;
D.过氧化钠为离子化合物,钠离子直接用离子符号表示,过氧根离子需要标出所带电荷及最外层电子,过氧化钠正确的电子式为: ,故D错误;
,故D错误;
故选D.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握电子式、结构式、离子结构示意图、比例模型与球棍模型等化学用语的表示方法,试题有利于培养学生规范答题的能力.


科目:高中化学 来源: 题型:解答题
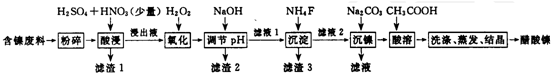
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
| Fe3+ | 1.1 | 3.2 | CaS04 | 微溶 | |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
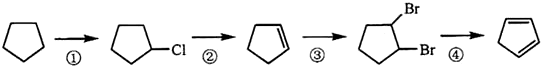
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
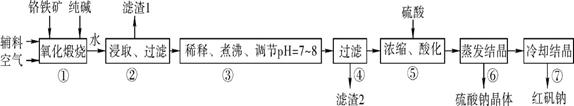
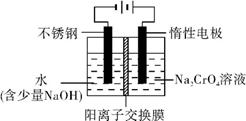
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正化合价:③>②>① | B. | 原子半径:②>①>③ | ||
| C. | 电负性:③>①>② | D. | 第一电离能:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2因导电能力强而用于制造通讯光缆 | |
| B. | 用秸秆中的纤维素直接水解制取燃料乙醇 | |
| C. | 处理废水时,加入明矾作为消毒剂除去水中的细菌 | |
| D. | 硅胶可作袋装食品的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| B. | 使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl-、S2- | |
| C. | $\frac{Kw}{c(H+)}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、AlO2- | |
| D. | 与铝反应产生大量H2的溶液中:Na+、NH4+、C6H5O-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com