
| A. | 最外层有6个电子 | B. | 位于元素周期表的第七周期 | ||
| C. | 主要化合价为-4价、+4价 | D. | “类铅”不能和盐酸反应放出氢气 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
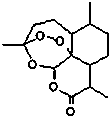 东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )
东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 能够发生水解反应 | |
| C. | 用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键或酯基等基团有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X单质、Y单质工业上均用电解其氧化物法得来 | |
| B. | Z、W两元素形成的不同化合物,Z的化合价一定不同 | |
| C. | Y的氧化物能与酸反应也能与碱反应,所以既是酸性氧化物又是碱性氧化物 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1KHS溶液中c(HS-)+c(S2-)+c(H2S)=0.1mol•L-1 | |
| B. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | pH=11的NaOH溶液与pH=3的CH2COOH溶液等体积混合后c(CH2COO-)>c(Na+)>c(H+)>c(0H-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(OH-)=c(HCO3-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
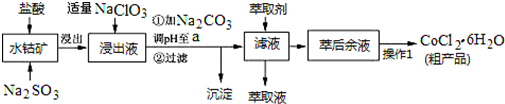
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
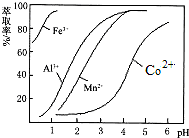
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
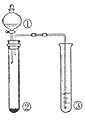 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2S | CuSO4 | 酸性:H2S>H2SO4 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com