
| A. | 是直链烃,但分子中3个碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比丁烷易液化 | |
| D. | 1 mol丙烷完全燃烧消耗5 mol O2 |
分析 A.烷烃分子中有多个碳原子应呈锯齿形,丙烷呈V形;
B.丙烷等烷烃在光照的条件下可以和氯气发生取代反应;
C.烷烃中碳个数越多沸点越高;
D.根据丙烷燃烧方程式C3H8+5O2→3CO2+4H2O来计算.
解答 解:A.烷烃分子中有多个碳原子应呈锯齿形,丙烷呈V形,3个碳原子不在一条直线上,故A正确;
B.丙烷等烷烃在光照的条件下可以和氯气发生取代反应,故B正确;
C.烷烃中碳个数越多沸点越高,丙烷分子中碳原子数小于丁烷,故丁烷沸点高,更易液化,故C错误;
D.由丙烷燃烧方程式C3H8+5O2$\stackrel{点燃}{→}$3CO2+4H2O可知,1 mol丙烷完全燃烧消耗5 mol O2,故D正确;
故选C.
点评 本题主要考查烷的结构与性质等,难度较小,注意基础知识的积累.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:解答题
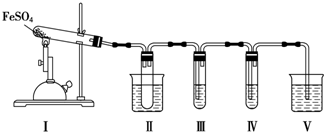
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有0.5mol•L-1BaCl2溶液 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有0.01mol•L-1酸性KMnO4溶液(或0.0l mol.L-1 溴水) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| B. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| C. | 高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PE和PVC制成的保鲜膜均有毒,不能用于保鲜食品 | |
| B. | 乙烯、聚乙烯和聚氯乙烯均能与溴水发生加成反应,使之褪色 | |
| C. | 上述流程中A是ClCH2CH2Cl,B是CH2═CHCl | |
| D. | ①②③④四步反应中,无消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸、浓硫酸、浓硝酸均具有氧化性,都属于氧化性酸 | |
| B. | Na2O、SO2、BaSO4在熔融状态或溶于水时均能导电,都属于电解质 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属于离子化合物 | |
| D. | 金刚石、二氧化硅、碳化硅晶体中原子间均以共价键结合,都属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 该化合物中只含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
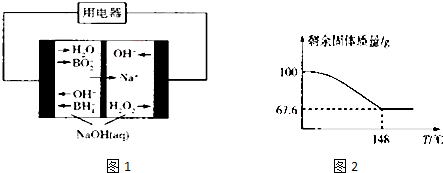
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com