
分析 加入氢氧化钠,消耗溶液中的氢离子,促进电离平衡右移,抑制水解平衡,据此分析.
解答 解:加入氢氧化钠,消耗溶液中的氢离子,促进电离平衡右移,则c(SO32-)增大,所以$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$的值增大,加NaOH,溶液中钠离子浓度增大,由于钠离子浓度增大的程度大于c(SO32-)增大程度,所以溶液中 $\frac{c(N{a}^{+})}{c(S{{O}_{3}}^{2-})}$ 的值增大;
故答案为:增大;增大.
点评 本题考查电解质溶液,涉及弱电解质的电离和盐类的水解,注意把握影响弱电解质电离平衡的因素和影响盐的水解平衡的因素,题目难度不大,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 溶液 | B. | 悬浊液 | C. | 乳浊液 | D. | 胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

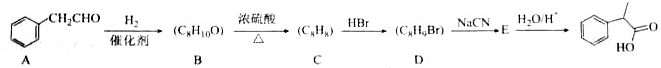
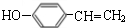 .
.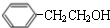 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$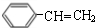 +H2O;C→D的反应类型为加成反应
+H2O;C→D的反应类型为加成反应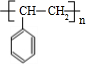 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲、乙、丙、丁 | B. | 丙、丁、乙、甲 | C. | 丙、丁、甲、乙 | D. | 丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图| A. | 在400℃时,反应①未达平衡,反应②达到平衡 | |
| B. | 800℃后再升高温度,反应①的平衡逆向移动;反应②的平衡正向移动 | |
| C. | 加压可提高NH3生成NO的转化率 | |
| D. | N2氧化为NO的热化学方程式为:N2(g)+O2(g)?2NO(g)△H=-181.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
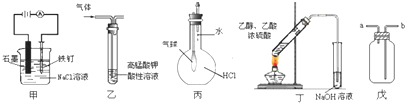
| A. | ①⑤ | B. | ②③ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某位同学在查阅资料时发现含氮化合物有以下性质:
某位同学在查阅资料时发现含氮化合物有以下性质:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应为化合反应 | |
| B. | “通路”是胶体对光产生的丁达尔现象 | |
| C. | 上述反应为氧化还原反应 | |
| D. | 产生的臭氧有毒,会严重影响人体健康 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com