
分析 n(CaCl2)=$\frac{11.1g}{111g/mol}$=0.1mol,结合HF的Ka计算c(F-),如生成沉淀,应满足c(Ca2+)•c(F-)2>Ksp,以此解答该题.
解答 解:n(CaCl2)=$\frac{11.1g}{111g/mol}$=0.1mol,c(Ca2+)=0.1mol/L,c(F-)=$\sqrt{Ka×c(HF)}$=$\sqrt{3.6×1{0}^{-4}×0.1}$mol/L=6×10-3mol/L,
则Qc=c2(F-)•c(Ca2+)=(3.6×10-5mol/L)•0.1 mol•L-1=3.6×10-6>Ksp,说明HF与CaCl2有沉淀产生,
答:HF与CaCl2反应.
点评 本题考查了难溶物溶解平衡及其应用,为高频考点,题目难度中等,明确难溶物溶解平衡的概念及影响因素为解答关键,试题培养了学生的化学计算能力,注意判断二者能否反应的角度是判断能否生成沉淀.


科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学试卷(解析版) 题型:简答题
(1)对于下列反应:2SO2(g) + O2(g) 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
(2)下图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________; 若增大压强时,反应速度变化情况画在c~d处。
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________; 若增大压强时,反应速度变化情况画在c~d处。

(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将___________(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时____________(填“增大”、“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 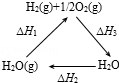 图中△H1=△H2+△H3 | |
| B. |  如图在催化剂条件下,反应的活化能等于E1+E2 | |
| C. | 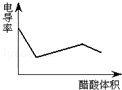 如图表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. |  如图可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{V}{2}$L | B. | $\frac{V}{3}$L | C. | $\frac{5V}{6}$L | D. | VL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.742吨 | B. | 0.85吨 | C. | 0.875吨 | D. | 1吨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
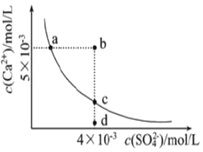
| A. | a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 | |
| B. | a点对应的Ksp不等于c点对应的Ksp | |
| C. | b点将有沉淀生成,平衡后溶液中c(Ca2+)•c(SO42-)一定等于9×10-6 | |
| D. | 向d点溶液中加入适量CaCl2固体可以变成c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
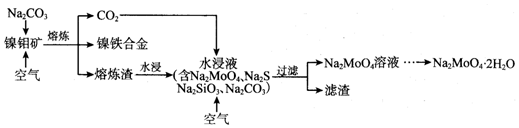

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| C. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH-+HCO3-═BaCO3↓+2H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com