
A、蒸发时,蒸发皿内所盛液体不超过蒸发皿容积的
| ||
| B、蒸发结晶时,不能直接蒸干液体,最后少量液体用余热蒸干 | ||
| C、用四氯化碳萃取碘水中的碘,分液时四氯化碳碘溶液从上口倒出 | ||
| D、蒸馏时,要在烧瓶中加入几粒碎瓷片 |
| 2 |
| 3 |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用加热法可除去Na2CO3中的NaHCO3 |
| B、Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 |
| C、可用石灰水区分Na2CO3与NaHCO3溶液 |
| D、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属铝溶于氢氧化钠溶液:Al+2OH-+2H2O=[Al(OH)4]-+H2↑ |
| B、过量铁溶于稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| C、用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| D、Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )
常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )| A、A酸比B酸的电离程度小 |
| B、pH=1时,B酸的物质的量浓度比A酸大 |
| C、B酸比A酸容易电离 |
| D、A是强碱,B是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
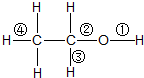
| A、与金属钠反应时,键①断裂 |
| B、与醋酸、浓硫酸共热时,键②断裂 |
| C、与HCl反应生成氯乙烷时,键②断裂 |
| D、与浓硫酸共热至170℃时,键②和④断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com