(2011?晋中三模)某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分).[已知碱式碳酸镁Mg
x(OH)
y(CO
3)
z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]
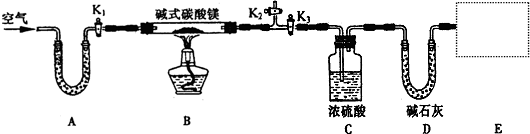
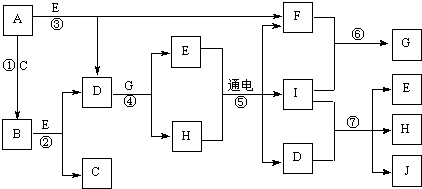
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是
检查装置的气密性
检查装置的气密性
;A处干燥管盛放的药品是
碱石灰(或氧化钙)
碱石灰(或氧化钙)
,其作用是
除去进入装置的空气中所含带的水蒸气和二氧化碳
除去进入装置的空气中所含带的水蒸气和二氧化碳
.
(2)指导老师在审阅设计方案后指出需要在E处进行改进,请你帮助该小组设计出改进方案:
添加一个盛有碱石灰(或氧化钙)的干燥管
添加一个盛有碱石灰(或氧化钙)的干燥管
.
(3)加热前需要进行的必要操作是
鼓入空气
鼓入空气
,其目的是
赶走装置中含有水蒸气和二氧化碳
赶走装置中含有水蒸气和二氧化碳
;对活塞的操作方法是:打开活塞
K1、K2
K1、K2
,关闭活塞
K3
K3
.
(4)关闭活塞K
1、K
2,打开K
3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于
B装置中的反应已完全
B装置中的反应已完全
.
(5)待B装置中的反应完全后,打开K
1,再缓缓鼓入空气数分钟,其目的是
将反应生成的残留在装置中的水蒸气和二氧化碳全部赶到装置C和D中
将反应生成的残留在装置中的水蒸气和二氧化碳全部赶到装置C和D中
.
(6)实验测得数据如下:碱式碳酸镁样品22.6g;反应前C装置的质量为87.6g,反应后质量为89.4g;反应前D装置的质量为74.7g,反应后质量为83.5g.请计算推导该碱式碳酸镁的化学式
Mg3(OH)2(CO3)2
Mg3(OH)2(CO3)2
,该碱式碳酸镁受热分解的化学方程式为
Mg
3(OH)
2(CO
3)
23MgO+2CO
2↑+H
2O
Mg
3(OH)
2(CO
3)
23MgO+2CO
2↑+H
2O
.




 全能测控一本好卷系列答案
全能测控一本好卷系列答案