
如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y。
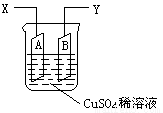
(1)当以IA的电流电解6min后,测得铜片A质量减少2.56g,则图装置中的X端应与直流电的 极相连。
(2)电解后将电源反接,2IA的电流电解6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度 mol/L。溶液中H+的物质的量浓度为 mol/L。
(3)列式计算实验测得的阿伏加德罗常数NA(用I表示) mol-1。(已知电子电量e=1.60×10–19C)
科目:高中化学 来源:2015-2016学年山东省济宁市兖州区高一上学期期中测试化学试卷(解析版) 题型:选择题
容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、② 浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
A.②④⑥ B. ①③⑤ C.①②④ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016届广西省高三上学期期中测试化学试卷(解析版) 题型:选择题
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是
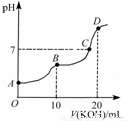
A.KHC2O4溶液呈弱碱性
B.B点时:c(HC2O4-)>c(K+)>c(H+)>c(OH-)
C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016届福建省厦门市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列有关离子方程式书写正确的是
A.向氯化铝溶液中滴加少量氨水:Al3++3OH—=Al(OH)3↓+ 2H2O
B.向氯化铁溶液中加入过量的锌粉:Zn + 2Fe3+ =2Fe2+ + Zn2+
C.以铁为电极电解NaCl溶液时,阳极的电极反应:Fe-3e— =Fe3+
D.硝酸亚铁溶液中滴入浓盐酸:3Fe2++ 4H+ + NO3—=3Fe3+ + NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上学期第三次测试化学试卷(解析版) 题型:选择题
将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下的气体0.224 L。则下列判断中正确的是
A.向溶液中滴入KSCN溶液,显血红色
B.原混合物中n(Fe)∶n(Fe2O3)=2∶1
C.无法计算原混合物的质量
D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源:2016届湖北省襄阳市高三上学期期中测试化学试卷(解析版) 题型:选择题
将34.2g C12H22O11(蔗糖)溶解在100 mL水中。关于所组成的溶液,下列叙述中正确的是
A.该溶液中溶质的物质的量浓度为1 mol·L-1
B.该溶液溶质的质量分数为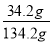 ×100%
×100%
C.该溶液中溶质的物质的量浓度的确定无需知道溶液的密度
D.该溶液溶质的质量分数的确定还需知道溶液的密度
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期11月月考化学试卷(解析版) 题型:选择题
下列实验操作正确的是
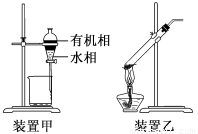
A.用玻璃棒蘸取HCl溶液点在用水湿润的pH试纸上,测定其pH
B.中和滴定时,滴定管用所盛装的反应液润洗2~3次
C.用装置甲分液,放出水相后再从分液漏斗下口放出有机相
D.用装置乙加热分解NaHCO3固体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上一次月考化学试卷(解析版) 题型:选择题
有人建议用AG表示溶液的酸度(acidity),AG的定义为AG=lg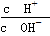 .下列表述正确的是
.下列表述正确的是
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG>0
C.在25℃时,若溶液呈碱性,则pH>7,AG<0
D.在25℃时,溶液的pH与AG的换算公式为AG=2×(7-pH)
查看答案和解析>>
科目:高中化学 来源:2016届浙江省杭州市高三上学期10月月考化学试卷(解析版) 题型:选择题
下列关于热化学方程式和反应的热效应的叙述中,正确的是
A.已知2C(s)+2O2(g) ==2CO2(g);△H1,2C(s)+O2(g)=2CO(g) ;△H2。则△H1<△H2
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)  2MH3(g)△H=-38.6kJ·mol-1
2MH3(g)△H=-38.6kJ·mol-1
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq) ===NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol
D.已知2H2(g)+O2(g)==2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com