
【题目】下列反应中,反应后固体物质质量减小的是 ( )
A. 二氧化碳通过Na2O2粉末 B. 镁条在二氧化碳中燃烧
C. CO通过灼热的CuO粉末 D. 将铝粉投入CuSO4溶液
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】持续的低温大雪使我国北方地区的“暖宝宝”成为紧俏商品。暖宝宝采用铁的“氧化放热”原理,使其发生原电池反应。已知制作暖宝宝的原料有铁粉、水、活性炭、蛭石、食盐,铁粉在原电池中充当
A.负极 B.正极 C.阴极 D.阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SF6是一种优良的绝缘气体,分子结构中只存在S﹣F键.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F﹣F、S﹣F键需吸收的能量分别为160kJ、330kJ.则S(s)+3F2(g)═SF6(g)的反应热△H为( )
A.﹣1780kJ/mol
B.﹣1220 kJ/mol
C.﹣450 kJ/mol
D.+430 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分子式为C5Hl2O并能与金属钠反应放出H2的有机化合物有________种;
(2)下列说法错误的是_____________;
A.有机物均易燃烧
B.苯酚酸性比碳酸弱,故苯酚不能与碳酸钠溶液反应
C.制取乙酸乙酯时,试剂的混合顺序是先加浓硫酸,再加乙醇,然后加乙酸
D.石油分馏得到的汽油是纯净物
(3)分子式为C5H9C1O2的同分异构体甚多,其中能与NaHCO3发生反应产生CO2的同分异构体共有________种;
(4)分子式为C3H6O2的链状有机物,核磁共振氢谱上峰的数目及强度比分别为:①3∶3;②3∶2∶1;③3∶1∶1∶1;④2∶2∶1∶1,则它们可能的结构简式依次为:
①_______________;②______________;
③_______________;④__________________。
(5)苯氧乙酸(![]() )有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是_______________(写出任意2种的结构简式)
)有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是_______________(写出任意2种的结构简式)
(6)按系统命名法,右图化合物的名称是___________
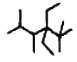
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子排布有能级顺序,若以E(nl)表示某能级的能量,以下各式中正确的是
A. E(4s)>E(3d)>E(3Px)>E(3Py)
B. E(3d)>E(4s)>E(3p)>E(3s)
C. E(5s)>E( 4f)>E(3Px)=E(3Py)
D. E(5s)>E(4s)>E( 4f)>E(3d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃,1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
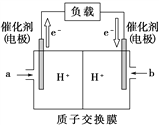
(2)上图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从________处通入(填“a”或“b”),电池内部H+向_______(填“左”或“右”)移动。写出电池负极的电极反应式________。正极的电极反应式_______________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。
试根据表中所列键能数据计算a的数值________。
当可逆反应中净生成N—H物质的量为2mol 时,反应放热_____________。
(4)已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g)的ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.增大体系压强,活化分子数增加,化学反应速率一定增大
B.加入反应物,使活化分子百分数增加,化学反应速率增大
C.活化分子间所发生的分子间的碰撞均为有效碰撞
D.升高温度,活化分子百分数增加,化学反应速率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

已知:
①海水中溴元素(以Br﹣表示)的浓度0.068g/L;
②Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.
(1)请写出两种海水淡化的方法:_______________________.
(2)海水中溴离子的物质的量浓度为____________________.
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br﹣,步骤Ⅲ又得到Br2,其目的为__________________.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________.
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用_____,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________.
(6)Br2是有机合成工业中的重要原料,甲苯的一溴代物有多种,其中苯环上的一氯代物只有两种的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学广泛应用于生活生产,下列说法正确的是
A.青铜器、硬币都属于纯净物
B.葡萄糖和银氨溶液发生银镜反应可用作制镜子
C.往花生油中加入稀硫酸能发生皂化反应
D.鸡蛋清中加入胆矾可以使蛋白质发生盐析
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com