
【题目】下列说法正确的是
A. 第Ⅰ![]() 族元素的金属性比第Ⅱ
族元素的金属性比第Ⅱ![]() 族元素的金属性强
族元素的金属性强
B. 第Ⅵ![]() 族元素的简单气态氢化物中,稳定性最强的其沸点也最高
族元素的简单气态氢化物中,稳定性最强的其沸点也最高
C. 同周期非金属元素的氧化物对应的水化物的酸性从左到右依次增强
D. 第二周期元素随族序数的递增,其最高化合价也递增
【答案】B
【解析】
A.同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强;
B.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,结合氢键判断沸点;
C.非金属最高价氧化物对应水化物的酸性越强,中心元素的非金属性越强;
D.氧元素、氟元素没有正化合价.
A.同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强,若不为同一周期,则不一定,如金属性Ca>Li,故A错误;
B.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,第ⅥA族元素的氢化物中,稳定性最好是H2O,氧元素电负性很大,水分子之间存在氢键,沸点故同主族其它元素氢化物中最高,故B正确;
C.同周期自左而右,非金属性增强,非金属最高价氧化物对应水化物的酸性越强,非金属元素化合价有多种,不一定是最高价,强调最高价氧化物最应水化物,故C错误;
D.氧元素、氟元素没有正化合价,故D错误;
故选:B。


科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和![]() 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是

A. 甲烧杯中溶液的![]() 逐渐减小 B. 乙烧杯中发生还原反应
逐渐减小 B. 乙烧杯中发生还原反应
C. 外电路的电流方向是从![]() 到
到![]() D. 电池工作时,盐桥中的
D. 电池工作时,盐桥中的![]() 移向甲烧杯
移向甲烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水只作为还原剂的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2B.2H2O
Fe3O4+4H2B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2Na2O2+2H2O═4NaOH+O2↑D.2F2+2H2O═4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是__________。
A.c(HA)<c(A-)
B.c(HA)一定大于0.1 mol·L-1
C.c(Na+)=c(HA)+c(A-)
D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是___________。
③已知在25 ℃时,CO32-水解反应的平衡常数Kh=2×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表、元素周期律及其相关应用叙述正确的是( )
A.原子的种类和元素的种类一样多
B.在现行元素周期表中,所含元素种数最多的是ⅢB族
C.可以在元素周期表金属与非金属分界处寻找催化剂
D.IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20世纪90年代末期,科学家发现并证明碳有新的单质形态![]() 存在。后来人们又相继得到了
存在。后来人们又相继得到了![]() 、
、![]() 、
、![]() 、
、![]() 等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
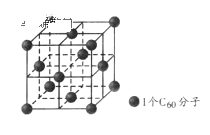
A. 熔点比较: ![]()
B. ![]() 、
、![]() 、管状碳和洋葱状碳之间的转化属于化学变化
、管状碳和洋葱状碳之间的转化属于化学变化
C. ![]() 晶体结构如上图所示,每个
晶体结构如上图所示,每个![]() 分子周围与它最近且等距离的
分子周围与它最近且等距离的![]() 分子有12个
分子有12个
D. ![]() 、
、![]() 、管状碳和洋葱状碳都不能与
、管状碳和洋葱状碳都不能与![]() 发生反应
发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜, 主要作用是在反应过程中只让Li+通过。结构如图所示。

原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A. 放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B. 放电时,电子由负极经导线、用电器、导线到正极
C. 充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D. 充电时,Li+向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。现有含FeClx杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
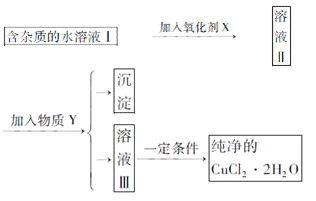
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是__________。
(3)本实验用加碱沉淀的目的是否能达到?__________。原因是__________。
(4)加氧化剂的目的为__________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________。如何操作?__________。·
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com