


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 1 | 2 | 3 | 4 |
| n[N2O5(g)]/mol | 1.00 | 0.80 | 0.64 | a | 0.5 |
| n[NO2(g)]/mol | 0.00 | 0.40 | b | 1 | 1 |
| n[X(g)]/mol | 0.00 | 0.10 | 0.18 | 0.25 | c |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 CrO2Cl2在有机合成中可作氧化剂或氯化剂,能与许多有机物反应,可用重铬酸钾与四氯化碳反应制备:
CrO2Cl2在有机合成中可作氧化剂或氯化剂,能与许多有机物反应,可用重铬酸钾与四氯化碳反应制备:查看答案和解析>>
科目:高中化学 来源: 题型:
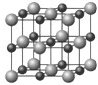
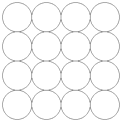 某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax.如图所示为Ax堆积的片层形式,然后第二层就堆积在第一层的空隙上.请根据Ax的堆积形式回答:(简要写出过程)
某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax.如图所示为Ax堆积的片层形式,然后第二层就堆积在第一层的空隙上.请根据Ax的堆积形式回答:(简要写出过程)查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
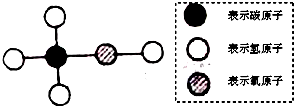
| A、甲醇的化学式为CH4O |
| B、甲醇的相对分子质量为32 |
| C、甲醇中C、H、O三种元素的质量比为1:4:1 |
| D、甲醇中氧元素的质量分数为50% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com