
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。

反应物X是_______(填“CO2”或“H2”)。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
(5)已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)CH3CH2OH(g)。当n(H2O):n(C2H4)=1

①图中压强p1、p2、p3、p4的大小顺序为:_______,理由是:_______。
②气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9 MPa,n(H2O):n(C2H4)=0.6:1。该条件下乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
【答案】3H2 (g)+CO2 (g)=CH3OH(g)+H2O(g) ΔH=-48.9 kJ/mol d CO2 B p4>p3>p2>p1 反应为气体体积减小的反应,增大压强平衡正向移动,乙烯的转化率增大,所以相同条件下,转化率越大的代表压强越大 其他条件不变,增加H2O(g)的浓度 其他条件不变,移出生成物
【解析】
(1)利用盖斯定律可知,将①+②可得:![]() ;
;
(2)![]() 是气体计量数减小的反应,正反应为放热反应,想要提高
是气体计量数减小的反应,正反应为放热反应,想要提高![]() 平衡产率,平衡需正向移动;
平衡产率,平衡需正向移动;
(3)同一反应,增加其中一种反应物的浓度,能提高另一种反应物的转化率,增大 ,使二氧化碳的转化率增大,而氢气的转化率降低;
,使二氧化碳的转化率增大,而氢气的转化率降低;
(4)分别对比AB、CD实验,在同样温度下,![]() 纳米片催化剂使反应速率增加,甲醇选择性高,所以选择BD进行比较,同样催化剂条件下,温度升高,
纳米片催化剂使反应速率增加,甲醇选择性高,所以选择BD进行比较,同样催化剂条件下,温度升高,![]() 转化率升高,而甲醇的选择性却降低;
转化率升高,而甲醇的选择性却降低;
(5)①在相同温度下由于乙烯转化率为![]() ,由
,由![]() 可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是
可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是![]() ;
;
②若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度等。
(1)利用盖斯定律可知,将①+②可得:![]() ,则
,则![]() ,故答案为:
,故答案为:![]() ;
;
(2)![]() 是气体计量数减小的反应,正反应为放热反应,想要提高
是气体计量数减小的反应,正反应为放热反应,想要提高![]() 平衡产率,平衡需正向移动;
平衡产率,平衡需正向移动;
a. 高压平衡向气体计量数减小的正反应方向移动,正反应为放热反应,高温平衡向吸热的逆反应方向移动,故a错误;
b. 正反应为放热反应,低温平衡向放热的正反应方向移动,低压向气体计量数增大的逆反应方向移动,故b错误;
c. 低压向气体计量数增大的逆反应方向移动,高温平衡向吸热的逆反应方向移动,故c错误;
d. 低温平衡向放热的正反应方向移动,高压平衡向气体计量数减小的正反应方向移动,故d正确;
故答案为:d;
(3)同一反应,增加其中一种反应物的浓度,能提高另一种反应物的转化率,图示,横坐标增大 ,相当于
,相当于![]() 不变时,增大
不变时,增大![]() ,平衡正向移动,使二氧化碳的转化率增大,而氢气的转化率降低,所以X为
,平衡正向移动,使二氧化碳的转化率增大,而氢气的转化率降低,所以X为![]() ,故答案为
,故答案为![]() ;
;
(4)分别对比AB、CD实验,在同样温度下,![]() 纳米片催化剂使反应速率增加,甲醇选择性高,所以选择BD进行比较,同样催化剂条件下,温度升高,
纳米片催化剂使反应速率增加,甲醇选择性高,所以选择BD进行比较,同样催化剂条件下,温度升高,![]() 转化率升高,而甲醇的选择性却降低,所以用
转化率升高,而甲醇的选择性却降低,所以用![]() 生产甲醇的最优选项为B,故答案为:B;
生产甲醇的最优选项为B,故答案为:B;
(5)①在相同温度下由于乙烯转化率为![]() ,由
,由![]() 可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是
可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是![]() ,故答案为:
,故答案为:![]() ;反应为气体体积减小的反应,增大压强平衡正向移动,乙烯的转化率增大,所以相同条件下,转化率越大的代表压强越大;
;反应为气体体积减小的反应,增大压强平衡正向移动,乙烯的转化率增大,所以相同条件下,转化率越大的代表压强越大;
②若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度等,故答案为:其他条件不变,增加H2O(g)的浓度;其他条件不变,移出生成物。


科目:高中化学 来源: 题型:
【题目】某固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3,某同学设计并完成如下实验:(所加试剂均过量)

已知:蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰呈紫色。
请回答:
(1)白色沉淀是__________________(填化学式)。
(2)生成红褐色沉淀的离子方程式为______________________。
(3)根据实验现象, 固体粉末中一定存在的组分是___________________________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O。下列说法不正确的是

A.a为负极,b为正极
B.该电池工作时PbO2电极附近溶液的pH增大
C.a极的电极反应为Cu-2e-=Cu2+
D.调节电解质溶液的方法是补充CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下pH为2的盐酸,下列叙述正确的是( )
A.将10mL该溶液稀释至100mL后,pH=4
B.向该溶液中加入等体积pH为12的氨水恰好完全中和
C.该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1
D.该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:
实验编号 | H2C2O4溶液 | 酸性KMnO4 | 温度 | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
0.10 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 50 | |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥__。
(2)试验编号②和③探究的内容是____。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=___mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组在T1温度下,向容积为1L的恒容密闭容器中,同时通入0.1mol CO(g)和0.1mol H2O(g),发生反应:CO(g)+H2O(g)CO2(g)+H2(g) △H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示:
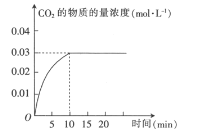
T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1、c(H2)=0.4 mol·L-1、c(CO2)=0.4 mol·L-1,则该反应在下一时刻将_______ (填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材采用图1实验装置测定锌与稀硫酸反应的速率。
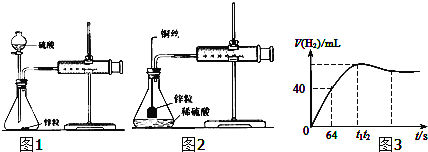
(1)检查图1装置气密性的操作方法是___。
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者___。
(3)同学们在实验操作中发现本实验设计存在明显不足,例如___。
(4)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
a.在多孔塑料袋中装入锌粒;
b.在锥形瓶中加入40mL1mol/L硫酸;
c.塞好橡胶塞,___时立即用秒表计时;
d.注射器内每增加5mL气体时读取一次秒表。
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是___,反应进行一定时间后速率逐渐减慢,原因是___。
(6)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是___;在64s内用H+浓度表示的平均反应速率v(H+)=___(此时,溶液体积仍为40mL,气体摩尔体积为25L/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列叙述中正确的是
A.1mol 葡萄糖分子含有的羟基数目为6NA
B.标准状况下,2.24 L Cl2溶于足量的水中充分反应后,溶液中Cl-数为0.1NA
C.100g 46%的乙醇溶液中,含H-O键的数目为NA
D.7 g CO(NH2)2与23 g乙酸组成的混合物中含氢原子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
苯甲酸钠 | 144 | — | 249.3 | 易溶于水 |
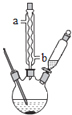
按下列合成步骤回答问题:
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL蒸馏水,再加入5mL浓硫酸,放入碎瓷片后,加热至沸腾,加入![]() 高锰酸钾,加热到甲苯层消失。将三颈瓶在冰水浴中冷却,分离出苯甲酸.
高锰酸钾,加热到甲苯层消失。将三颈瓶在冰水浴中冷却,分离出苯甲酸.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入![]() 苯甲酸和适量的
苯甲酸和适量的![]() 的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
①球形冷凝管的作用是 ______ ,其进水口是 ______ ![]() 填“a”或“b”
填“a”或“b”![]() .
.
②三颈瓶中反应的离子方程式 ______ .
③分离苯甲酸选用的玻璃仪器是 ______ ![]() 填标号
填标号![]()
A分液漏斗B玻璃棒C烧杯D漏斗E蒸馏烧瓶F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是 ______ ,为进一步提纯,应采用的方法是 ______ .
⑤控制温度为70℃的方法是 ______ .
⑥加入活性炭的作用是 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com