
【题目】亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。SO2和浓硝酸在浓硫酸存在时可制备NOSO4H,反应原理为:SO2 + HNO3 = SO3 + HNO2、SO3 + HNO2 = NOSO4H。
(1)亚硝酰硫酸(NOSO4H)的制备。
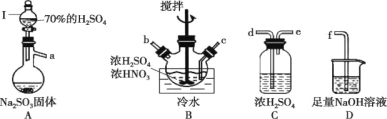
①仪器I的名称为______________,打开其旋塞后发现液体不下滴,可能的原因是_________________。
②按气流从左到右的顺序,上述仪器的连接顺序为__________________(填仪器接口字母,部分仪器可重复使用)。
③A中反应的方程式为___________。
④B中“冷水”的温度一般控制在20℃,温度不宜过高或过低的原因为________。
(2)亚硝酰硫酸(NOSO4H)纯度的测定。
称取1.500 g产品放入250 mL的碘量瓶中,并加入100.00 mL浓度为0.1000 mol·L-1的KMnO4标准溶液和10 mL 25%的H2SO4,摇匀;用0.5000 mol·L-1的Na2C2O4标准溶液滴定,滴定前读数1.02 mL, 到达滴定终点时读数为31.02 mL。
已知:i:□KMnO4 + □NOSO4H + □______ = □K2SO4 + □MnSO4 + □HNO3 + □H2SO4
ii:2KMnO4 + 5Na2C2O4 + 8H2SO4 = 2MnSO4 +10CO2↑+ 8H2O
①完成反应i的化学方程式:_____________
□KMnO4 + □NOSO4H + □______ = □K2SO4 + □MnSO4 + □HNO3 + □H2SO4
②滴定终点的现象为____________________。
③产品的纯度为__________________。
【答案】分液漏斗 分液漏斗上口的瓶塞未打开或漏斗未与大气相通或漏斗下端活塞的凹槽未与瓶颈上的通气孔对齐 a→de→cb→de→f Na2SO3+H2SO4= Na2SO4+H2O+SO2↑或Na2SO3+2H2SO4= 2NaHSO4+SO2↑ 温度过低,反应速率太慢,温度过高,浓硝酸易分解,SO2逸出 2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4 滴入最后一滴Na2C2O4标准液后,溶液由紫红色变为无色,且半分钟颜色不恢复 84.67%
【解析】
(1)①根据图示中装置的形外分析名称;漏斗内的液体与大气相通时液体才能顺利流下;
②亚硝酰硫酸(NOSO4H)遇水易分解,装置A制取的SO2中含有水蒸气,必须先干燥在通入B中反应制取亚硝酰硫酸(NOSO4H)时,要防止空气中或其他实验仪器中的水蒸气进入B中,SO2有毒,未反应的剩余SO2不能排放到大气中;据此分析;
③硫酸和亚硫酸钠反应生成硫酸钠(或硫酸氢钠)和二氧化硫;
④温度影响反应速率,同时浓硝酸不稳定;
(2)①根据氧化还原反应,化合价升降(电子得失)守恒及物料守恒分析配平;
②在氧化还原滴定操作中,高锰酸钾自身为紫红色,发生氧化还原反应时紫色褪去,自身可做滴定操作的指示剂;
③结合反应ii,根据题给数据计算过量的KMnO4的物质的量,在结合反应i计算NOSO4H的物质的量,进而求算产品纯度。
(1)①根据图示中装置A图所示,仪器I为分液漏斗;漏斗内与大气相通时液体才能顺利流下,打开其旋塞后发现液体不下滴,可能的原因是分液漏斗上口的瓶塞未打开或漏斗未与大气相通或漏斗下端活塞的凹槽未与瓶颈上的通气孔对齐;
②亚硝酰硫酸(NOSO4H)遇水易分解,装置A制取的SO2中含有水蒸气,必须先干燥在通入B中反应制取亚硝酰硫酸(NOSO4H),同时要防止空气中或其他实验仪器中的水蒸气进入B中,通入SO2时要尽量使SO2充分与反应物混合,提高SO2利用率,SO2有毒,未反应的剩余SO2不能排放到大气中,上述仪器的连接顺序为:a→de→cb→de→f;
③硫酸和亚硫酸钠反应生成硫酸钠(或硫酸氢钠)和二氧化硫,反应方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑或Na2SO3+2H2SO4=2NaHSO4+SO2↑;
④温度影响反应速率,同时浓硝酸不稳定,温度过低,反应速率太慢,温度过高,浓硝酸易分解,SO2逸出,导致反应产率降低;
(2)①反应中锰元素的化合价由+7价降低为+2价,亚硝酰硫酸中氮元素的化合价由+3价升高为+5价,根据氧化还原反应,化合价升降(电子得失)守恒及物料守恒,配平该方程式为:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4;
②在氧化还原滴定操作中,高锰酸钾自身为紫红色,发生氧化还原反应时紫色褪去,自身可做滴定操作的指示剂,用0.5000molL1草酸钠标准溶液滴定过量的高锰酸钾溶液,溶液颜色变化是紫红色变为无色且半分钟不变说明反应达到终点;
③根据反应ii:2KMnO4+5Na2C2O4+8H2SO4=2MnSO4+10CO2↑+8H2O,过量的KMnO4的物质的量=![]() ×0.5000molL1×(31.02mL-1.02mL)×10-3/L=0.006mol,则与NOSO4H反应的高锰酸钾物质的量=0.1000molL1×0.1L0.006mol=0.004mol,在结合反应i:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4,NOSO4H的物质的量=
×0.5000molL1×(31.02mL-1.02mL)×10-3/L=0.006mol,则与NOSO4H反应的高锰酸钾物质的量=0.1000molL1×0.1L0.006mol=0.004mol,在结合反应i:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4,NOSO4H的物质的量=![]() ×0.004=0.01mol,产品的纯度为=
×0.004=0.01mol,产品的纯度为=![]() ×100%=84.67%。
×100%=84.67%。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
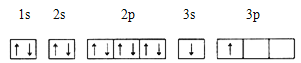
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区。
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与CN-互为等电子体的单质的电子式 。
③六氰合亚铁离子[Fe(CN)6]4-中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
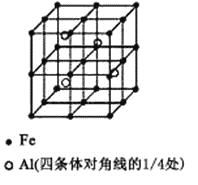
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于以下反应:A(s)+3B(g)![]() 2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
A.容器的体积不再发生变化
B.B的生成速率和D的反应速率之比为3∶1
C.混合气体的密度不随时间变化
D.B、C、D的分子个数之比为3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铬废水中铬的存在形式有三价铬和六价铬两种,其中以六价铬的毒性最大。工业常用还原沉淀法处理含Cr2O72-和CrO42-的废水,其工艺流程如下:
![]()
下列叙述不正确的是
A.“转化”过程中溶液由橙色变为黄色
B.“还原”反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
C.在酸性条件下,用铁板作阳极电解含铬废水也可以将Cr2O72-还原为Cr3+
D.还原沉淀法产生的污泥是混合污泥不利于回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
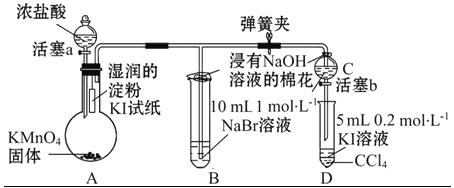
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是_________________。
(2)验证氯气的氧化性强于碘的实验现象是_____________________________。
(3)B中溶液发生反应的离子方程式是_________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。一种锂离子电池充电时的阳极反应式为:LiFePO4-xe-=xFePO4+(1-x)LiFePO4+xLi+,放电时的工作原理如图。下列叙述不正确的是
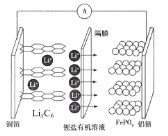
A.该电池工作时Fe、P元素化合价均不变
B.放电时,电子由铜箔经外电路流向铝箔
C.充电时,铝箔电极应该接电源的正极
D.充电时,Li+通过隔膜移向铜箔电极方向迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )

A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是

A.图1:锌铜原电池中,Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度减小
B.图2:纽扣式银锌电池中,正极的电极反应式为Ag2O+2e-+H2O+2H+=2Ag+2H2O
C.图3:锌锰干电池中,锌筒作负极,发生氧化反应,锌筒会变薄
D.图4:铅蓄电池使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com