

分析 用氢氧化钠溶液浸取硼镁矿,溶液I含有BO2-,结合硼镁矿的化学式可知沉淀I为Mg(OH)2,过滤分离,滤液中通入二氧化碳调节pH,结晶析出硼砂(无水物化学式为Na2B4O7),再加入硫酸得到硼酸,硼酸微溶于水,过滤分离.
(1)沉淀I的主要成份为氢氧化镁,将硼镁矿粉碎、搅拌、适当加热等可以加快碱浸速率,操作Ⅱ是分离互不相溶的固体与液体;
(2)溶液I含有Na+、BO2-离子,通入二氧化碳得到Na2B4O7,还得到碳酸钠或碳酸氢钠;
(3)硼砂与硫酸反应生成新酸与新盐,反应得到硼酸与硫酸钠;
硫酸钠为强酸强碱盐,硼砂、苏打均为强碱弱酸盐,由反应可知硼酸的酸性比碳酸的弱;
(4)硼酸是一元酸,与氢氧化钠按物质的量1:1反应,可以计算氢氧化钠的物质的量浓度;
(5)在催化剂存在下,NaBH4可水解产生稳定的氢气(氧化剂与还原剂物质的量比为2:1),水是氧化剂,结合质量守恒、电荷守恒可知有BO2-生成.
解答 解:用氢氧化钠溶液浸取硼镁矿,溶液I含有BO2-,结合硼镁矿的化学式可知沉淀I为Mg(OH)2,过滤分离,滤液中通入二氧化碳调节pH,结晶析出硼砂(无水物化学式为Na2B4O7),再加入硫酸得到硼酸,硼酸微溶于水,过滤分离.
(1)沉淀I的主要成份为Mg(OH)2,将硼镁矿粉碎、搅拌、适当加热、增大氢氧化钠溶液浓度等可以加快碱浸速率,操作Ⅱ是分离互不相溶的固体与液体,采取过滤方法分离,
故答案为:Mg(OH)2;镁矿粉碎、适当加热;过滤;
(2)溶液I含有Na+、BO2-离子,通入二氧化碳得到Na2B4O7,还得到碳酸钠或碳酸氢钠,反应离子方程式为:2Na++4BO2-+CO2=Na2B4O7↓+CO32-,
故答案为:2Na++4BO2-+CO2=Na2B4O7↓+CO32-;
(3)硼砂与硫酸反应生成新酸与新盐,反应得到硼酸与硫酸钠,反应化学方程式为:Na2B4O7+H2SO4+5H2O=4H3BO3+Na2SO4,
硫酸钠为强酸强碱盐,溶液呈中性,硼砂、苏打均为强碱弱酸盐,溶液呈碱性,由反应可知硼酸的酸性比碳酸的弱,Na2B4O7溶液的碱性更强,故溶液pH顺序:Na2B4O7>Na2CO3>Na2SO4,
故答案为:Na2B4O7+H2SO4+5H2O=4H3BO3+Na2SO4;Na2B4O7>Na2CO3>Na2SO4;
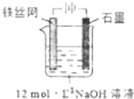
(4)硼酸是一元酸,与氢氧化钠按物质的量1:1反应,消耗NaOH为0.01mol,则氢氧化钠的物质的量浓度为$\frac{0.01mol}{0.02L}$=0.05mol/L,反应方程式为:H3BO3+OH-=BO2-+2H2O,
故答案为:0.5;H3BO3+OH-=BO2-+2H2O;
(5)在催化剂存在下,NaBH4可水解产生稳定的氢气(氧化剂与还原剂物质的量比为2:1),水是氧化剂,NaBH4+2H2O→4H2,结合质量守恒、电荷守恒可知有BO2-生成,水解时的化学方程式为:NaBH4+2H2O=4H2↑+NaBO2,
故答案为:NaBH4+2H2O=4H2↑+NaBO2.
点评 本题考查物质制备工艺流程,涉及物质的分离提纯、对操作与原理的分析、化学方程式书写等,侧重对方程式书写的考查,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ③④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 使用此装置处理过的废气就不会对大气造成污染了 | |
| B. | 装置内发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用澄清的石灰水检验经过处理的废气是否达标 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0Ll.0mol.L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA | |
| C. | 25C时pH=11的Na2C03溶液中水电离出的OH-的数目为0.001NA | |
| D. | 氧原子总数为0.2NA的S02和O2的混合气体,其体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可
我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可| A. | 铝合金 | B. | 铜合金 | C. | 碳纤维 | D. | 硅纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com