
室温下,若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1, 满足此条件的溶液中一定可以大量共存的离子组是( )
满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NH4+、Cl- B.K+、Na+、Cl-、AlO2-
C. K+、Na+、Cl-、NO3- D.K+、CO32-、SO42-、NO3-
科目:高中化学 来源:2016-2017学年海南省高二上期中文化学卷(解析版) 题型:选择题
关于食物的酸碱性说法错误的是( )
A.蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物
B.葡萄吃起来是酸的,故它属于酸性食物
C.食物的酸碱性与化学上所指溶液的酸碱性不同的
D.正常人人体内各体液pH总保持一定范围
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考文化学卷(解析版) 题型:选择题
用CCl4 把碘从碘水中提取出来的方 法是
法是
A.萃取 B.过滤 C.蒸发 D.蒸馏
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考理化学卷(解析版) 题型:选择题
对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液1 mL稀释至100 mL后,pH等于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考理化学卷(解析版) 题型:选择题
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是( )
A.10℃ 20 mL 3 mol·L-1的X溶液
B.20℃ 10 mL 4 mol·L-1的X溶液
C.20℃ 30 mL 2 mol·L-1的X溶液
D.10℃ 10 mL 2 mol·L-1的X溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上期中化学卷(解析版) 题型:选择题
按下列实验方法操作,能达到要求的是
A. 用托盘天平称量25.20g氯化钠固体
B. 实验室制取蒸馏水时,圆底烧瓶中加些碎瓷片防止暴沸
C. 加热饱和FeCl2溶液制备Fe(OH)3胶体
D. 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上期中化学卷(解析版) 题型:选择题
在KC1、MgCl2、Mg(NO3)2形成的混合溶液屮,c(K+)=0.1mol/L,c(Mg2+)=0.15mol/L, c(Cl-) = 0.2mol/L,则c(NO3-)为
A.0.05 mol/L B.0.20mol/L C.0.30 mol/L D.0.40 mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省、醴陵四中高二上期中化学卷(解析版) 题型:选择题
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
CH3COOH H++CH3COO-;FeCl3+3KSCN
H++CH3COO-;FeCl3+3KSCN Fe(SCN)3+3KCl
Fe(SCN)3+3KCl

N2(g)+3H2(g) 2NH3(g);CH3OCH3(g)+3H2O(g)
2NH3(g);CH3OCH3(g)+3H2O(g) 6H2(g)+2CO2(g)ΔH>0
6H2(g)+2CO2(g)ΔH>0

A.向100mL 0.1mol/L醋酸溶液中逐渐加入醋酸钠晶体过程中溶液pH的变化趋势图。
B.向FeCl3溶液和KSCN溶液混合后反应达 平衡后, 向混合液中逐渐加入固体KCl过程中c(Fe3+)的变化趋势图。
平衡后, 向混合液中逐渐加入固体KCl过程中c(Fe3+)的变化趋势图。
C.密闭容器中进行N2(g)+3H2(g)  2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图。
2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图。
D.密闭容器中进行CH3OCH3(g)+3H2O(g)  6H2(g)+2CO2(g) ΔH>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图。
6H2(g)+2CO2(g) ΔH>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图。
查看答案和解析>>
科目:高中化学 来源:2017届陕西西安市高三上模拟三化学试卷(解析版) 题型:填空题
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1) 可逆反应N2+3H2 2NH3是工业上合成氨的重要反应
2NH3是工业上合成氨的重要反应
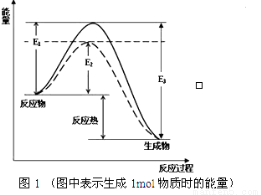
根据图1请写出合成氨的热化学方程式:_______________(热量用E1、E2或E3表示)。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为__________。
(3)氮化锂是非常有前途的储氢材料,其在氢气中加热中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2 LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
(4)LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠,已知电池放电时总反应式为FePO4+Li═LiFePO4 ,电池正极反应为____________________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
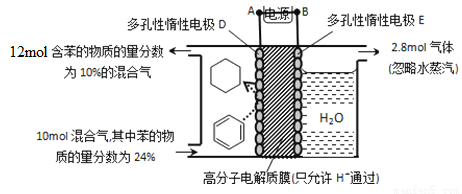
①导线中电子移动方向为____________。(用A、D表示)
②生成目标产物的电极反应式为__________________________。
③该储氢装置的电流效率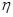 =__________________________。
=__________________________。
(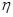 =
= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com