
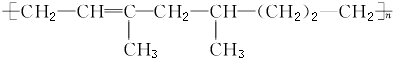
| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1 mol该物质能与1 mol H2加成,生成不含碳碳双键的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |
分析 该物质中含有碳碳双键,具有烯烃性质,能发生加成反应、氧化反应、还原反应等,根据高聚物结构简式知,形成该物质的单体为CH2=CHC(CH3)=CH2、CH3CH=CH2、CH2=CH2,据此分析解答.
解答 解:A.该物质中只含碳碳双键,是由CH2=CHC(CH3)=CH2、CH3CH=CH2、CH2=CH2通过加聚反应得到的,故A正确;
B.根据A知,形成该高分子化合物的单体有3种,故B正确;
C.1mol该物质含有nmol碳碳双键,所以1mol该物质能与nmolH2加成,生成不含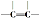 的物质,故C错误;
的物质,故C错误;
D.该物质中含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查高分子化合物性质,难点是单体判断,易错选项是A.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:H4SiO4<H2CO3<HNO3 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 金属性:Na<Mg<Al | D. | 熔点:金刚石>食盐>干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 天然气和沼气的主要成分是甲烷 | |
| B. | 石油裂解可以得到氯乙烯 | |
| C. | 所有烷烃中都存在碳碳单键 | |
| D. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液产生白色沉淀 | B. | 加入碘水不变蓝 | ||
| C. | 加入BaCl2溶液没有白色沉淀产生 | D. | 加入碘水变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 加入少量0.1mol/L的盐酸,电离平衡向左移动,c(H+)减小 | |
| C. | 加入少量NaOH固体,电离平衡向右移动,溶液导电性增强 | |
| D. | 加入少量CH3COONa固体,电离平衡不移动,溶液导电性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医院里常用无水乙醇杀菌、消毒 | |
| B. | 乙醇和乙酸都能与NaOH溶液反应 | |
| C. | 乙酸乙酯中的乙酸可用饱和Na2CO3溶液除去 | |
| D. | 乙烯、聚乙烯和苯分子中均含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al>Mg=Fe>Na | B. | Al=Mg=Fe=Na | C. | Na>Al>Mg>Fe | D. | Al=Mg=Fe<Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com