
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对
与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强。 请仔细阅读上述材料,回答下列问题:
(1)指出下面物质分子或离子的空间构型:PO43-_____________________________; PCl5_____________________。
(2) 有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
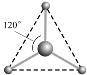 __________________;
__________________; __________________。
__________________。
(3) 按要求写出第二周期非金属元素构成的中性分子的化学式:平面三角形分子___________,三角锥形分子___________,四面体形分子_____________。
(4) 下列一组微粒中键角由大到小顺序排列为____________________(用编号填写)
①HCN ②SiF4 ③SCl2 ④CO32- ⑤H3O+
【答案】正四面体 三角双锥 CH3+ CH3- BF3 NF3 CF4 ①④②⑤③
【解析】
(1) PO43-磷酸根离子价层电子对个数为4,且不含孤电子对,为sp3杂化类型;PCl5价层电子对数为5,且不含孤电子对,是sp3d杂化;
(2)根据分子的空间构型、杂化类型以及价层电子对数结合粒子中均含有1个碳原子和3个氢原子来分析判断;
(3)由第二周期非金属元素构成的中性分子,第二周期元素为中心原子,如果是平面形分子,则通过sp2杂化形成中性分子;如果是三角锥型分子,则通过sp3杂化形成中性分子,且价层电子对个数是4,含有一个孤电子对;如果是正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,据此分析解答;
(4)根据价层电子对互斥模型可以推出①HCN;②SiF4;③SCl2;④CO32-; ⑤H3O+的空间构型和键角。
(1)PO43-磷酸根离子价层电子对个数为4,且不含孤电子对,为sp3杂化类型,空间构型为正四面体形;PCl5价层电子对数为5,且不含孤电子对,是sp3d杂化,中心是5个电子对,呈三角双锥;
(2)第一种微粒的空间结构为平面三角形,则碳原子为sp2杂化,中心碳原子无孤电子对,因此价层电子对数3,化学式为CH3+,第二种微粒的空间结构为三角锥形,则碳原子为sp3杂化,中心碳原子有1个孤电子对,因此价层电子对数4,化学式CH3-,故答案为:CH3+;CH3-;
(3)由第二周期非金属元素构成的中性分子,第二周期元素为中心原子,通过sp2杂化形成中性分子,是平面形分子,该类型分子有BF3;第二周期元素为中心原子,通过sp3杂化形成中性分子,如果是三角锥型分子,则该分子中价层电子对个数是4且含有一个孤电子对,该类型分子有NF3;如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,该类型分子有CF4,故答案为:BF3;NF3;CF4;
(4)①HCN为直线形分子(中心碳原子采取sp 1 杂化),键角180°;②SiF 4 为正四面体结构,键角为109.5°;③SCl 2 为V形结构,键角接近90°;④CO 32- 为平面形结构,键角120°;⑤H 3O+ 为三角锥形结构,小于109.5°,但大于90°。所以键角由大到小顺序排列为①④②⑤③。


科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0
B.CaCO3(s)=CaO(s)+CO2(g) △H>0
C.N2(g)+3H2(g) ![]() 2NH3(g) △H<0
2NH3(g) △H<0
D.2CO(g)=2C(s)+O2(g) △H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101 kPa时,1 g N2H4在氧气中完全燃烧生成氮气和H2O(l),放出19.5 kJ热量(25 ℃时),表示N2H4燃烧的热化学方程式是____________________________ 。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4 mol液态肼和足量液态H2O2反应,生成氮气和液态水,放出327.05 kJ的热量。写出该反应的热化学方程式:__________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________________________________________。
(4)下图是一定量丙烷完全燃烧生成CO2 和1mol H2O (l)过程中的能量变化图。
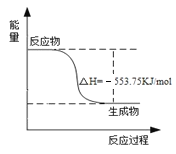
写出表示丙烷燃烧热的热化学方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟化硫分子呈正八面体(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起强温室效应,下列有关六氟化硫的推测正确的是( )
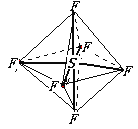
A.六氟化硫易燃烧生成二氧化硫
B.六氟化硫中各原子均达到8电子稳定结构
C.S—F键是 σ键,且键长、键能都相等
D.六氟化硫分子中只含极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
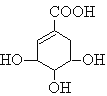
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液羧基和羟基均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如图:
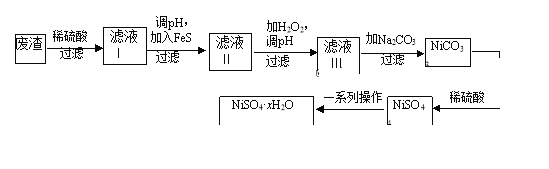
(1)在待镀件上镀镍时,待镀件应作____极,电镀过程中电解质溶液浓度___ (填“增大”、“减小”、“不变”)
(2)向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为_____________.当Zn2+恰好沉淀完全时,在CuS、ZnS共存的混合液中c(Zn2+)=10﹣5mol/L,则c(Cu2+)=______mol/L(已知Ksp(CuS)=1.3×10﹣36,Ksp(ZnS)=1.6×10﹣24).
(3)对滤液Ⅱ中先加H2O2再调pH,调pH的目的是______________________________________________________________________.
(4)为测定NiSO4·xH2O晶体x的值,称取26.3g晶体加热至充全失去结晶水,剩余固体15.5g,则x的值等于__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题。
(1)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等.
①As的基态原子的电子排布式[Ar]_______________.
②第一电离能:As___Ga(填“>”、“<”或“=”).
(2)配合物Fe(CO)5常温下呈液态,熔点为-20.5 ℃,易溶于 CCl4 中,则Fe(CO)5是______分子(非极性或极性)。
(3)BF3常温下是气体,有强烈的接受孤电子对的倾向。BF3与NH3相遇,立即生成白色固体。BF3的杂化轨道类型为:____ ;写出该白色固体的结构式,并标注出其中的配位键___________。
(4)下列有关说法不正确的是____。
A.沸点:NH3 >PH3,CH3OH > HCHO
B.SO2与CO2的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4 , 原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小

(5)钠钾合金属于金属晶体,某种合金的晶胞结构如图所示,晶体中K 原子的配位数为______;已知金属原子半径r(Na)、r(K),计算晶体的空间利用率 __________(假设原子是刚性球体)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com