
| A. | c(OH-) | B. | n(NH4+) | C. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | D. | n(OH-) |
分析 用适量水稀释0.1mol/L氨水时,溶液中随着水量的增加,一水合氨的电离程度增大,则氢氧根离子、铵根离子的物质的量增大,但氢氧根离子的浓度会减小,据此进行判断.
解答 解:A.稀释过程中一水合氨的电离程度增大,由于溶液体积变化更大,则氢氧根离子的浓度减小,故A正确;
B.稀释过程中铵根离子、氢氧根离子的物质的量增大,故B错误;
C.稀释过程中氢氧根离子、铵根离子的物质的量增大,一水合氨的物质的量减小,由于溶液体积相同,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$的比值会增大,故C错误;
D.稀释过程中一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,故D错误;
故选A.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度不大,明确电离平衡及其影响因素为解答关键,注意稀释过程中一水合氨的电离程度增大,但溶液中氢氧根离子的浓度减小,为易错点,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 有机化合物的1H核磁共振分析中,氢原子核所处的化学环境不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置也就不同 | |
| B. | 红外光谱是利用有机物分子中不同基团的特征吸收频率不同,测试并记录有机化合物对一定波长范围的红外光吸收情况,根据对红外光谱的分析,可以初步判断该有机化合物中具有哪些基团 | |
| C. | 有机化合物中的“基”是一成不变的 | |
| D. | 质谱法是用高能电子束轰击有机物分子,使之分离成带电的“碎片”,并根据“碎片”的某些特征谱分析有机物结构的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | V(NaOH) | V(HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.00 | 0.00 | 16.70 | 16.70 | 0.1044 |
| 2 | 16.75 | 0.00 | 17.85 | 17.85 | |
| 3 | 19.55 | 0.00 | 20.80 | 20.80 | 0.1064 |
| 4 | 15.00 | 0.00 | 16.00 | 16.00 | 0.1067 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | NaOH与HCl的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
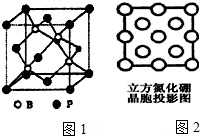 由N、B等元素组成的新型材料有着广泛用途.
由N、B等元素组成的新型材料有着广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
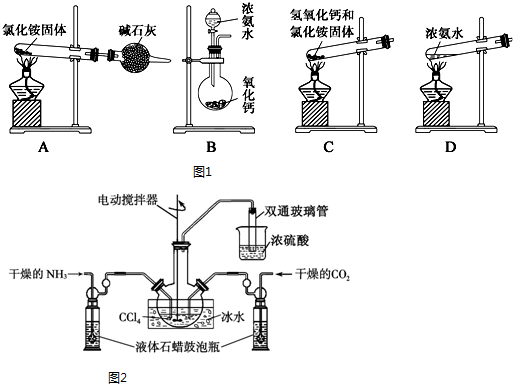
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: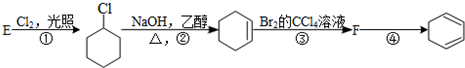
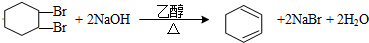 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com