
| A. | 向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO32- | |
| C. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
分析 A.二价铁离子还原性强于溴离子,氯气少量,先氧化二价铁离子;
B.反应生成苯酚和碳酸氢钠;
C.硫酸氢钠与氢氧化钡按照物质的量2:1反应时,溶液显示中性;
D.铁离子具有氧化性,能够与碘离子反应氧化还原反应生成亚铁离子和碘单质.
解答 解:A.向溴化亚铁溶液中通入少量氯气,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故A正确;
B.苯酚钠溶液中通入少量CO2,离子方程式:C6H5O-+CO2+H2O-→C6H5OH+HCO3-,故B错误;
C.硫酸氢钠溶液中滴入氢氧化钡溶液至中性,氢氧根离子与钡离子的计量数关系产物,正确的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C错误;
D.将氢氧化铁粉末加入氢碘酸中,反应生成亚铁离子、碘单质和水,正确的离子方程式为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故D错误;
故选:A.
点评 本题考查了离子方程式的书写判断,掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题关键,注意反应物用量对反应的影响.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10 -10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | X、Z、M的最简单离子半径大小为X>M>Z | |
| B. | X、Z、R的最高价氧化物的水化物之间不可两两相互反应 | |
| C. | R的氢化物比Q的氢化物沸点高、更稳定 | |
| D. | Y的氢化物的水溶液可用于雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
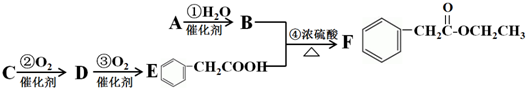
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠溶液中加入双氧水有氧气放出:ClO-+H2O2═O2↑+Cl-+H2O | |
| B. | 碳酸钙溶于稀醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 用稀硝酸洗涤做过银镜反应的试管:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| D. | 苯酚钠溶液中通入少量CO2: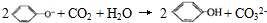 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定硫酸铜晶体中结晶水的含量,失水后的硫酸铜晶体置于空气中冷却后再称量质量 | |
| B. | 测定中和热实验中,所使用的氢氧化钠稀溶液的物质的量浓度稍大于盐酸 | |
| C. | 配制一定的物质的量浓度溶液的实验中,容量瓶内壁附有蒸馏水 | |
| D. | 用标准盐酸滴定未知浓度的氢氧化钠溶液,开始俯视读数,终点仰视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 实验编号 | 温度 | 金属铝的形态 | 酸及浓度 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响 2.实验②和③探究探究温度对反应速率的影响 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 25℃ | 铝片 | 4.0moL/L盐酸 |
| ② | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| ③ | 35℃ | 铝片 | 2.0moL/L盐酸 | |
| ④ | 25℃ | 铝粉 | 2.0moL/L盐酸 | |
| ⑤ | 25℃ | 铝片 | 2.0moL/L硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com