
| A. | HF的沸点高于HCl | B. | 金刚石的熔点比晶体硅高 | ||
| C. | 稀有气体一般很难发生化学反应 | D. | 常温下单质溴呈液态、碘呈固态 |
分析 A.分子晶体的沸点与分子间作用力有关;
B.原子晶体的熔点与共价键有关;
C.稀有气体原子的电子排布为稳定结构;
D.分子晶体的熔沸点与分子间作用力有关.
解答 解:A.HF分子之间存在氢键,HCl分子间存在范德华力,氢键的作用力大于范德华力,所以HF的沸点高于HCl,故A不选;
B.原子晶体的熔点与共价键有关,原子半径越小,共价键键能越大,原子晶体的熔点越高,所以金刚石的熔点比晶体硅高,故B选;
C.稀有气体原子的电子排布为稳定结构,不容易得失电子,所以一般很难发生化学反应,故C不选;
D.单质溴中分子间作用力小于单质碘中分子间作用力,单质溴的熔点低于单质碘,因此常温下单质溴呈液态、碘呈固态,故D不选.
故选B.
点评 本题考查晶体的熔沸点的比较以及化学键知识,侧重于学生的分析能力和基础知识的综合运用,难度不大,注意基础知识的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
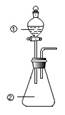 向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ① | ② | 现象 |
| A | 浓盐酸 | 二氧化锰 | 产生黄绿色气体 |
| B | 氯化铁溶液 | 铁氰化钾溶液 | 产生蓝色沉淀 |
| C | 浓硝酸 | 用砂纸打磨过的铝条 | 无明显现象 |
| D | 偏铝酸钠 | 稀盐酸 | 立即产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均增大 | B. | 均不变 | C. | ①增大,②不变 | D. | ①减小,②不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol•L-1 | B. | 0.225 mol•L-1 | C. | 0.30 mol•L-1 | D. | 0.45 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 配制CuSO4溶液 | 将硫酸铜晶体溶于热水中,然后稀释 |
| B | 除去试管内壁的银镜 | 加入浓氨水浸泡,再用蒸馏水洗涤 |
| C | 提纯含少量乙酸的乙醇(乙醇沸点78.5℃) | 加入生石灰后进行蒸馏,收集78.5℃馏分 |
| D | 证明HClO为弱酸 | 用洁净的玻璃棒蘸取NaClO溶液在pH试纸上,待试纸变色后与标准比色对照 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O属于碱性氧化物 | |
| B. | Na2CO3长期暴露在空气中变为NaHCO3 | |
| C. | NaOH溶液保存在带玻璃塞的玻璃瓶中 | |
| D. | 向NaHCO3溶液中滴加稀盐酸,开始时无想象,一段时间后有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NF3分子的空间构型为三角锥形 | |
| B. | 叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-,则N2O与N3-互为等电子体 | |
| C. | 叠氮化物与Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,则其中钴的配位数为8 | |
| D. | NaN3与KN3的结构类似,则NaN3的晶格能大于KN3的晶格能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀 | |
| B. | AlCl3溶液和Al2(SO4)3溶液分别加热蒸发,所得固体的成分相同 | |
| C. | 室温时将Na2CO3溶液加水稀释后,再恢复至室温,pH和KW均减小 | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com