
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合物中铜和铁各0.15mol | |
| B. | 第一次剩余9.6g金属为铜和铁 | |
| C. | 稀硝酸的物质的量浓度为2.0mol/L | |
| D. | 向反应后的溶液中再加入该硝酸200mL,又得到标准状况下的NO体积小于2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
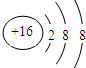 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁合金的硬度比镁小 | |
| B. | 推广使用无磷洗衣粉主要是为了防止水体富营养化 | |
| C. | 纯碱可作治疗胃酸过多的一种药剂 | |
| D. | SO2可用于漂白一切有色物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com