
【题目】某班同学用如下实验探究Na2CO3、NaHCO3的性质.回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是 .
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示: 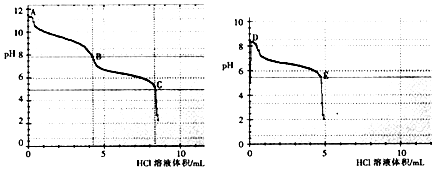
①碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是(填A、B、C、D或E).
②B点的主要溶质是(用化学式表示).
③B点(填“大于”或“小于”) D点的pH,主要原因是 .
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式: .
【答案】
(1)碳酸钠与水反应生成Na2CO3?xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量
(2)BC;NaCl和NaHCO3;小于;B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点
(3)2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑
【解析】解:(1)Na2CO3、NaHCO3固体,各滴加几滴水,是碳酸钠与水反应生成结晶水合物,是放热反应,而碳酸氢钠是溶解于水是吸热的过程,所以答案是:碳酸钠与水反应生成Na2CO3xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量;(2)①碳酸钠与盐酸反应首先碳酸钠转化为碳酸氢钠,所以第一次溶液呈碱性,达到两次反应终点是B,然后碳酸氢钠与盐酸反应生成氯化钠,呈中性,达到两次反应终点是C,故选:BC;②由①知B点的主要溶质是NaCl和NaHCO3 , 所以答案是:NaCl和NaHCO3;③B点溶液溶解了少量二氧化碳,使溶液呈酸性,同时B点碳酸氢钠的浓度小于D点碳酸氢钠的浓度,所以B点的PH小于D点的PH,所以答案是:小于;B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点;(3)NaHCO3有酸性,所以碳酸氢根离子电离产生氢离子和碳酸根离子,氢离子与镁反应生成氢气和镁离子,所以反应方程式为:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑,所以答案是:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑.


科目:高中化学 来源: 题型:
【题目】浓硫酸具有很强的腐蚀性,化学实验时一定要特别注意安全。如果不慎有少量浓硫酸沾到皮肤上,必须迅速用大量的水冲洗,然后再涂上( )
A.3%~5%的碳酸氢钠溶液B.2%~5%的硼酸溶液
C.5%~10%的氢氧化钠溶液D.5%~10%的稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于石油、煤、天然气等化石能源的说法正确的是( )
A.石油产品﹣﹣直馏汽油和裂化汽油的成分相同
B.获得上述化石能源的过程均为化学变化
C.水煤气是通过煤的液化得到的气体燃料
D.天然气是一种清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假如你是一位企业家,在开发海水资源的众多项目中,选择了海水提镁,在前期考察过程中你将遇到许多问题,请根据背景材料的提示,按要求回答相关问题:
材料1:下图为海水中各元素含量情况(mg/L)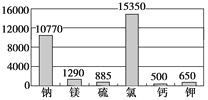
材料2:部分化学试剂的市场价格
试剂 | 氢氧化钾 | 氢氧化钠 | 氢氧化钙 | 氧化钙 |
价格(元/吨) | 5238.0 | 2300.00 | 1200.00 | 700.00 |
请回答下列问题:
(1)在海水提镁的过程中要实现对镁离子的富集、分离,有以下三个方案:
方案一:直接往海水中加入沉淀剂;
方案二:加热蒸发海水后再加入沉淀剂;
方案三:在晒盐后的卤水中加入沉淀剂。
你认为方案最合理。
不选方案的理由是。
不选方案的理由是。
(2)应该选择试剂作为镁离子的沉淀剂。不考虑其他费用,沉淀相同量的镁离子所用氢氧化钠和氧化钙的价格比为。
(3)为了节省成本,你可考虑以海边上的贝壳为原料,试简述其理由:?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.丙池中盛有100mL3.00molL﹣1的CuSO4溶液.试回答下列问题: 
(1)在电源中,B电极为极(填电极名称,下同);乙装置中粗铜为极.
(2)在甲装置中,石墨(C)电极上发生反应(填“氧化”或“还原”);甲装置中总的化学方程式是 .
(3)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为L.
(4)在丙装置中,X电极上发生的电极反应式是 .
(5)在此过程中,若丙池中两电极产生的气体恰好相等时,理论上在乙池中精铜增加了g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是绿色氧化剂,且酸性介质下由更强的氧化性,易溶于水显弱酸性,常温下K1=1×10﹣12 , K2=1×10﹣25 , 回答下列问题:
(1)常温下水的电离平衡的常数K约为 , K、K1、K2从大到小顺序为;
(2)在硫酸亚铁存在条件下,H2O2溶液可以把苯(C6H6)氧化为苯酚(C6H5OH),反应后的混合物经过、蒸馏得到苯酚,理论上制取1mol苯酚需要消耗H2O2mol,实际消耗大于理论用量的主要原因是
(3)K4[Fe(CN)6](黄色溶液)、K3[Fe(CN)6](黄绿色溶液)与一定量H2O2组成的混合物,用酸或碱调节混合溶液的pH,会出现黄色、黄绿色交替变化,按照从酸性至碱性的顺序,可观察到的现象是;
(4)工业用H2O2除去废水中的Cl2 , 氧化产物是;与SO2除Cl2相比,其优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种新型可生物降解的高分子材料,主要制造可降解纤维、塑料和医用材料,其水解最终产物为N.燃烧9.0g的N只产生CO2和H2O,且质量分别为13.2g和5.4g,实验测得N在标准状况下的蒸气密度为4.02g/L;N的核磁共振氢谱显示的峰面积之比为1:1:1:3.
(1)通过计算确定N的分子式
(2)写出由N在催化剂条件下缩聚反应合成M的化学方程式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家规定,酿造食醋的总酸含量标准为3.5~5.0g/100mL(总酸含量即100mL食醋中CH3COOH的质量).某化学兴趣小组为测定某市售食醋的总酸含量,进行了实验.实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应.计算该市售食醋样品中的总酸含量,并说明是否符合国家标准.(假设该市售食醋样品中其他物质不与氢氧化钠发生反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧聚乙炔.其中既能使酸性KMnO4溶液褪色,也能与溴水反应而使溴水褪色的是( )
A.②③⑤
B.②③⑦
C.②③⑧
D.②③⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com