
| A. | 原子最外层电子数的周期性变化 | |
| B. | 原子半径呈现从大到小的周期性变化 | |
| C. | 元素化合价呈现周期性的变化 | |
| D. | 元素的金属性和非金属性呈现周期性的变化 |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:推断题
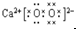 :和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;
:和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制盐酸溶液,用量筒取盐酸时俯视刻度线 | |
| B. | 配制盐酸溶液定容时,仰视容量瓶 | |
| C. | 称量4gNaOH配制0.20mol/L NaOH溶液500mL时,砝码错放左盘 | |
| D. | 配制NaOH溶液时,溶液未经冷却即注入容量瓶并定容至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥ | B. | ①②④⑥ | C. | ③⑤⑥ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
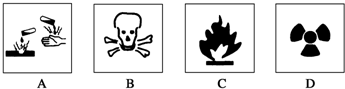
| A. | 浓硫酸----A图标 | B. | 酒精----B图标 | ||
| C. | 汽油----C图标 | D. | 放射性物品----D图标 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
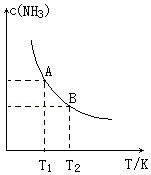 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,发生反应为:N2(g)+3H2(g)?2NH3(g)△H=a kJ/mol,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为33.3%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,发生反应为:N2(g)+3H2(g)?2NH3(g)△H=a kJ/mol,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为33.3%.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com