
【题目】拆开1 mol共价键所吸收的能量或形成1 mol共价键所释放的能量称为键能。已知:H—H键能为436 kJ/mol,H—N键能为391 kJ/mol,N2 (g)+ 3H2(g) ![]() 2NH3(g) ΔH=92.4 kJ/mol,下列说法中正确的是( )
2NH3(g) ΔH=92.4 kJ/mol,下列说法中正确的是( )
A.H—H比N≡N更牢固
B.N≡N键能约为946 kJ/mol
C.合成氨反应选择适当的催化剂是为了提高H2的转化率
D.0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
【答案】B
【解析】
A. △H=反应物的键能和-生成物的键能和,-92.4KJ/mol=Q(N≡N)+3×436KJ/mol-6×391KJ/mol,Q(N≡N)=946KJ/mol,大于H-H键的键能,所以,N≡N键牢固,故A错误;
B. △H=反应物的键能和-生成物的键能和,-92.4KJ/mol=Q(N≡N)+3×436KJ/mol-6×391KJ/mol,Q(N≡N)=946KJ/mol,故B正确;
C. 催化剂只能加快化学反应速率,不影响化学平衡的移动,不能提高H2的转化率,故C错误;
D. 合成氨是可逆反应,反应物不能完全转化,所以,0.5mol N2和1.5mol H2在题给条件下充分反应,放出热量小于46.2 kJ,故D错误;
正确答案是B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,从![]() 出发合成BHT的方法有如下两种。下列说法不正确的是( )
出发合成BHT的方法有如下两种。下列说法不正确的是( )
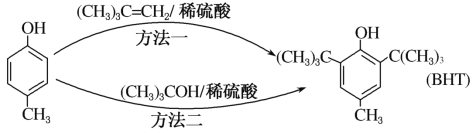
A. 方法一和方法二的反应类型都是加成反应
B. BHT与![]() 都能使酸性KMnO4溶液褪色
都能使酸性KMnO4溶液褪色
C. 推测BHT在水中的溶解度小于苯酚
D. BHT与![]() 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。
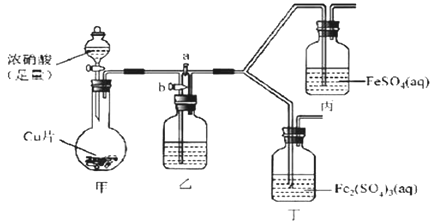
Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
![]() 元素的基态原子的价电子排布图为______,B、N、O元素的第一电离能由大到小的顺序为______。
元素的基态原子的价电子排布图为______,B、N、O元素的第一电离能由大到小的顺序为______。
![]() 三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性气味的无色有毒腐蚀性气体,其分子的立体构型为______,B原子的杂化类型为______。
三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性气味的无色有毒腐蚀性气体,其分子的立体构型为______,B原子的杂化类型为______。
![]() 自然界中,含B的钠盐是一种天然矿藏,其化学式写作
自然界中,含B的钠盐是一种天然矿藏,其化学式写作![]() ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个![]() 和两个
和两个![]() 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成![]() ,其结构式如图1,它的阴离子可形成链状结构。该阴离子由极性键和配位键构成,请在答题卷中抄上图1结构式后用“
,其结构式如图1,它的阴离子可形成链状结构。该阴离子由极性键和配位键构成,请在答题卷中抄上图1结构式后用“![]() ”标出其中的配位键,该阴离子通过______相互结合形成链状结构。
”标出其中的配位键,该阴离子通过______相互结合形成链状结构。
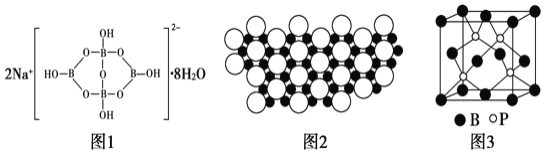
![]() 科学家发现硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图2是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为______。
科学家发现硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图2是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为______。
![]() 磷化硼
磷化硼![]() 是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图3所示,在BP晶胞中B的堆积方式为______,当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为______cm。
是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图3所示,在BP晶胞中B的堆积方式为______,当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应: PCl3(g)+Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40molB.0.20mol
C.小于0.20molD.大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在等温等容条件下,有下列气体反应:2A(g)+2B(g)![]() C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ:A、B的起始浓度均为2mol/L。Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是( )
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ:A、B的起始浓度均为2mol/L。Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是( )
A.Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的平均相对分子质量不同
B.Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同
C.达到平衡时Ⅰ途径的VA等于Ⅱ途径的VA
D.达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略) 则X、Y、Z可能是( )
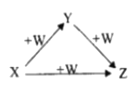
①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、 NaA1O2
③ Fe、 FeCl2、FeCl3 ④NaOH、Na2CO3 、NaHCO3 ⑤C、CO、CO2
A.①②④⑤B.①③⑤C.②④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol![]() 中含有的碳碳双键数为4NA
中含有的碳碳双键数为4NA
B.1 L 0.1mol/L NH4Cl溶液中含有NH![]() 的数目为0.1NA
的数目为0.1NA
C.6.2g白磷分子中含P-P键为0.2 NA
D.7.8gNa2O2和Na2S的固体混合物中含有的离子总数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com