
(1)氧化铜与盐酸反应:O![]() +2H
+2H![]() ==H
==H![]() O。正确的离子方程式是___________。
O。正确的离子方程式是___________。
(2)碳酸钡加入稀盐酸中:CO![]() +2H
+2H![]() ==CO
==CO![]() ↑+H
↑+H![]() O。
O。
正确的离子方程式是________________________________。
(3)铝粉加入硫酸铜溶液中:Cu![]() +Al==Cu+Al
+Al==Cu+Al![]() 。正确的离子方程式是________。
。正确的离子方程式是________。
(4)亚硫酸和氢氧化钡溶液混合:Ba![]() +SO
+SO![]() ==BaSO
==BaSO![]() ↓。
↓。
正确的离子方程式是________________________________。
科目:高中化学 来源: 题型:
 某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:查看答案和解析>>
科目:高中化学 来源: 题型:
 下图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去).已知F可用作化肥,也可用来制炸药;G可用于作防腐剂或建筑工程上的抗冻剂.据此回答以下问题:
下图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去).已知F可用作化肥,也可用来制炸药;G可用于作防腐剂或建筑工程上的抗冻剂.据此回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
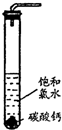 实验一、定性探究:
实验一、定性探究: HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO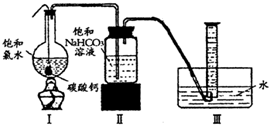
| BL |
| 22.4L/mol |
| Ag |
| 100g/mol |
查看答案和解析>>
科目:高中化学 来源:2015届吉林省松原市高一下期中考试化学试卷(解析版) 题型:填空题
某市中学化学兴趣小组利用下图所示原电池装置进行实验,请回答下列问题:

(1)实验中,同学们发现两装置电流计的指针偏转方向不同,因此有人提出以下观点,其中正确的是____________。(双选题,漏选得2分,多选错选得0分)
A.金属活动性铝比镁强
B.金属活动性镁比铝强,两装置中镁均为负极
C.仅根据金属活动性顺序不能准确判断原电池的正负极
D.原电池中的正负极受电解质溶液的酸碱性、强氧化性等因素的影响
(2)要准确判断原电池的正负极除了可用电流计等仪表测量外,还可以通过观察现象来判断,请写出乙图中的电极材料及反应现象。(设镁铝均为纯净金属)
正极: 负极: 。
(3)写出甲图中的电极反应式:
①负极: _________________________;
②正极: _________ __________ 。
(4)乙图中铝片与NaOH溶液反应的离子方程式为___________________________________。某同学测得乙图中实验前铝片的质量是5g,实验后的质量是2.3g,则在实验过程中产生氢气的体积为_______(标况),转移电子的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com