
| A. | 空气 SO2、NO、NO2、CO | |
| B. | 碱性溶液 Na+、K+、NO3-、CO32- | |
| C. | 酸性溶液 Na+、ClO-、SO42-、SiO32- | |
| D. | KNO3溶液 Fe2+、H+、Cl-、Cu2+ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②将铜丝向下移动使其与浓硝酸接触 | 产生红棕色气体,用排水法收集气体 | 可以用该装置制备NO2 |
| C | ③光照 | 试管颜色变浅,出现油状滴液,少量白雾 | 甲烷与氯水发生取代反应 |
| D | 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
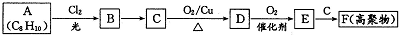
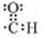 ;E一→F反应类型为缩聚反应.
;E一→F反应类型为缩聚反应. .
. .
.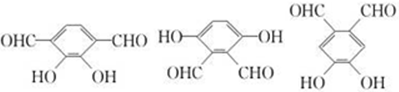 (2种即可).
(2种即可).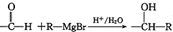 现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J(
现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J( ),则
),则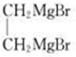 ,
,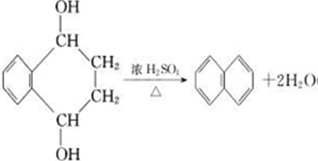 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
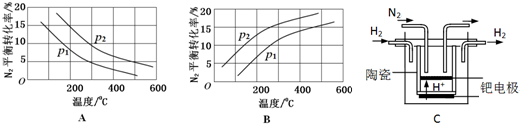
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
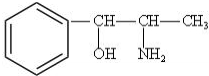 构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知:
构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知: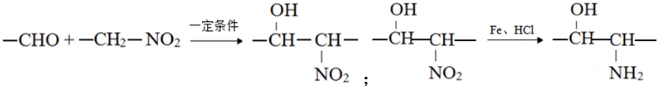
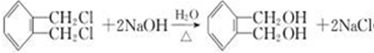
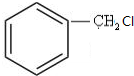 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$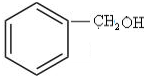 +NaCl.
+NaCl.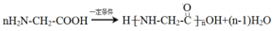 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO | C. | N2O5 | D. | NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com