
【题目】在金属冶炼产生的废弃物中,常含有砷元素(与磷同主族),由于有毒需检测与处理。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
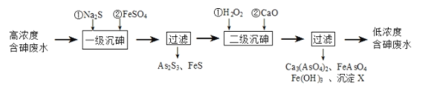
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为___;砷酸的第一步电离方程式为__。
(2)“一级沉砷”中FeSO4的作用是___。
(3)“二级沉砷”中H2O2与含砷物质反应的化学方程式为___。沉淀X为___(填化学式)。
Ⅱ.强阴离子交换柱可以吸附以阴离子形态存在的As(V)达到去除As的目的。采用该方法去除水体中的砷时,可选用NaClO将As(Ⅲ)转化为As(V)。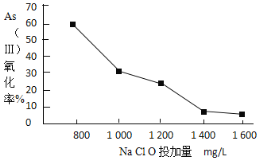
已知:一定条件下,As(V)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO4 | HAsO42 | HAsO42、AsO43 |
(4)pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是___。
Ⅲ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成(即未能检出)。
(5)请写出步骤2的离子方程式____。
【答案】+3 H3AsO4![]() H++H2AsO4- 沉淀过量的S2-,使As2S3(s)+3S2-(aq)
H++H2AsO4- 沉淀过量的S2-,使As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O CaSO4 ClO-+ H3AsO3=H2AsO4+Cl-+H+ 2AsH3+12Ag++3H2O=12Ag+As2O3+12H+
2AsS33-(aq)平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O CaSO4 ClO-+ H3AsO3=H2AsO4+Cl-+H+ 2AsH3+12Ag++3H2O=12Ag+As2O3+12H+
【解析】
Ⅰ.(1)H为+1价,O为-2价,依据化合物中各元素的化合价的代数和为0,可求出As元素的化合价;在第ⅤA族非金属元素形成最高价含氧酸中,磷、砷形成的含氧酸都是弱酸,在水溶液中分步电离。
(2)高浓度含砷废水中加入Na2S后,发生反应As2S3+3S2-2AsS32-,为提高除砷效果,需将产物再次转化为As2S3,加入FeSO4就是为了达到使平衡逆向移动的目的。
(3)“二级沉砷”中H2O2与含砷物质反应,将亚砷酸氧化为砷酸,自身被还原为水。加入氧化钙和水反应生成氢氧化钙,氢氧化钙和砷酸反应生成砷酸钙沉淀,与铁离子反应生成氢氧化铁沉淀,钙离子结合硫酸根离子形成硫酸钙沉淀
(4)pH=6时,NaClO氧化亚砷酸(H3AsO3)生成H2AsO4,ClO-被还原为Cl-。
(5)在酸性环境中,将AsH3气体通入AgNO3溶液中,生成银镜和As2O3,则反应物为AsH3和Ag+,生成物为Ag、As2O3等。
Ⅰ.(1)亚砷酸(H3AsO3)中氢元素+1价,氧元素-2价,化合物中各元素化合价代数和为0,则砷元素的化合价为+3价,第ⅤA族非金属元素形成最高价含氧酸中磷、砷形成的含氧酸都是弱酸,在水溶液中分步电离,电离方程式为:H3AsO4H++H2AsO4-,故答案为:+3;H3AsO4![]() H++H2AsO4-;
H++H2AsO4-;
(2)“一级沉砷”中FeSO4的作用是除去过量的硫离子,As2S3+3S2-2AsS32-使平衡逆向进行,提高沉砷效果,“二级沉砷”中H2O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸;反应的化学方程式为:H2AsO3+H2O2=H3AsO4+H2O;答案为:沉淀过量的S2-,使As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)平衡左移,提高沉砷效果;H3AsO3+H2O2=H3AsO4+H2O。
2AsS33-(aq)平衡左移,提高沉砷效果;H3AsO3+H2O2=H3AsO4+H2O。
(3)流程分析可知,加入氧化钙和水反应生成氢氧化钙,氢氧化钙和砷酸反应生成砷酸钙沉淀,与铁离子反应生成氢氧化铁沉淀,钙离子结合硫酸根离子形成硫酸钙沉淀,所以沉淀X为CaSO4;答案为:CaSO4。
(4)pH=6时,NaClO氧化亚砷酸(H3AsO3)生成H2AsO4,ClO-被还原为Cl-,反应的离子方程式为ClO-+ H3AsO3=H2AsO4+Cl-+H+;答案为:ClO-+ H3AsO3=H2AsO4+Cl-+H+。
(5)将AsH3气体通入AgNO3溶液中,生成银镜和As2O3,则反应物为AsH3和Ag+,生成物为Ag、As2O3等,溶液为酸性环境。反应的离子方程式为2AsH3+12Ag++3H2O=12Ag
+As2O3+12H+;答案为:2AsH3+12Ag++3H2O=12Ag+As2O3+12H+。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示吸热反应、置换反应、氧化还原反应之间的关系,从下列选项反应中选出属于区域V的是( )
![]()
A.Na2O2+2CO2=Na2CO3+O2B.NaOH+HCl=NaCl+H2O
C.2NaHO3=2Na2CO3+H2O+CO2↑D.2Na+2H2O=NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不正确的是
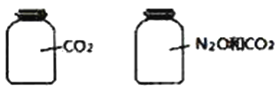
A. 所含氧原子数相等 B. 气体的总质量相等
C. 气体所含电子总数相等 D. 气体的密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用于航天飞行器中的一种全天候太阳能电化学电池在光照时的工作原理。下列说法正确的是
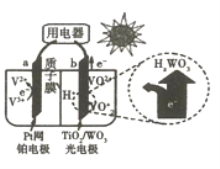
A. 该电池与硅太阳能电池供电原理相同
B. 光照时,H+由a极室通过质子膜进入b极室
C. 光照时,b极反应为VO2++2OH--e-=VO2++H2O
D. 夜间无光照时,a电极流出电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示:

已知:①RCH2Br![]() R-HC=CH-R’
R-HC=CH-R’
②R-HC=CH-R’![]()
③R-HC=CH-R’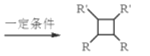
(1)A属于芳香烃,其名称是________________。
(2)B的结构简式是______________________。
(3)由C生成D的化学方程式是__________________。
(4)与![]() 互为同分异构体且符合下列条件的有机物有_________种(不含立体异构)。
互为同分异构体且符合下列条件的有机物有_________种(不含立体异构)。
①苯环上只有两个取代基
②与![]() 含有相同的官能团
含有相同的官能团
③酸性条件下的水解产物能使FeCl3溶液显紫色。
写出其中核磁共振氢谱为五组峰的结构简式:_________(写一种即可)
(5)试剂b是_______________。
(6)下列说法正确的是________(填字母序号)。
a.G存在顺反异构体
b.由G生成H的反应是加成反应
c.1 mol G最多可以与1 mol H2发生加成反应
d.1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 mol NaOH
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_____。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是
A. NH3![]() NO
NO![]() HNO3
HNO3
B. 浓盐酸![]() Cl2
Cl2![]() 漂白粉
漂白粉
C. Al2O3![]() AlCl3(aq)
AlCl3(aq)![]() 无水AlCl3
无水AlCl3
D. 葡萄糖![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com