
| A. | H2S解离度增大 | B. | H2S平衡常数减小 | C. | 溶液pH下降 | D. | 溶液pH增大 |
科目:高中化学 来源: 题型:选择题
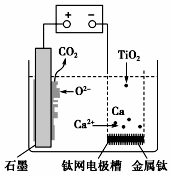 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )| A. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| B. | 阳极的电极反应式为C+2O2--4e-═CO2↑ | |
| C. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子 | |
| D. | 若用铅蓄电池作供电电源,“-”接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
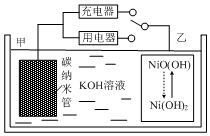 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 放电时,乙电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O | |
| C. | 充电时,电池的碳电极与直流电源的正极相连 | |
| D. | 电池总反应为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以利用铝热反应冶炼高熔点的金属 | |
| B. | 现代石油化工,采作银作催化剂可以实现一步完成乙烯转化为环氧乙烷的过程,该反应的原子利用率为100% | |
| C. | 工业上制溴是向酸化的浓缩海水中直接通入氯气置换出溴即可 | |
| D. | 煤直接液化可得液体燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
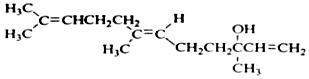 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )| A. | 可使酸性 KMnO4溶液褪色 | |
| B. | 橙花醇中含有2种官能团 | |
| C. | 在浓硫酸催化下加热脱水,生成的产物不止一种 | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锡青铜的熔点比纯铜高 | |
| B. | 在自然环境中,锡青铜中的锡可对铜起保护作用 | |
| C. | 锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 | |
| D. | 生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+b=14 | B. | a+b=13 | C. | a+b=15 | D. | a+b=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| B. | 若单位时间内生成x mol N2的同时,消耗2x molNH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,2v (H2) 正=3v (NH3) 逆 | |
| D. | 加入催化剂,正反应速率增大,逆反应速率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com