
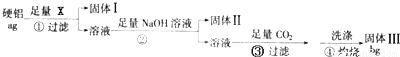
 Al2O3+3H2O,故固体Ⅲ是Al2O3,
Al2O3+3H2O,故固体Ⅲ是Al2O3, Al2O3+3H2O;
Al2O3+3H2O;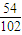 =
= bg,即为ag合金中Al的质量为
bg,即为ag合金中Al的质量为 bg,故合金中Al的质量分数
bg,故合金中Al的质量分数 ×100%=
×100%=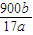 %,故答案为:
%,故答案为: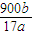 %;
%;

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组选用一种硬铝合金(主要含铝,其次是镁、硅、铜)进行实验探究。向1.500g样品中加入足量盐酸,待反应完毕后,收集到气体1736mL(标准状况下)。将反应混合物过滤,向滤液中加入过量NaOH溶液,充分反应后再过滤;向滤液中通入足量CO2滤出沉淀。将沉淀加热蒸干、灼烧,得白色固体2.550 g。请计算这种硬铝合金中含镁的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com