
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. |  2-甲基丁烷 2-甲基丁烷 |
分析 A.该有机物为丁二烯,不是二丁烯;
B.该有机物为乙酸与乙二醇发生酯化反应生成的酯;
C.羟基在2号C,羟基的编号错误;
D.该有机物为烷烃,主链为丁烷,甲基在2号C.
解答 解:A.CH2=CH-CH=CH2为二烯烃,分子中含有4个C,碳碳双键在1、3号C,其名称为:1,3-丁二烯,故A错误;
B.CH3COOCH2CH2OOCCH3为二乙酸乙二酯,不是乙二酸二乙酯,故B错误;
C.CH3CH2CH(OH)CH3中羟基在2号C,正确名称为2-丁醇,故C错误;
D. 的最长碳链含有4个C,主链为丁烷,在2号C含有1个甲基,其名称为:2-甲基丁烷,故D正确;
的最长碳链含有4个C,主链为丁烷,在2号C含有1个甲基,其名称为:2-甲基丁烷,故D正确;
故选D.
点评 本题考查了有机物命名,题目难度不大,明确常见有机物的命名原则为解答关键,A为易错点,注意二丁烯和丁二烯的区别,试题培养了学生的规范答题能力.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 将氢碘酸加到Fe(OH)3胶体中 Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 以惰性电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+Cl2↑ | |
| C. | 碳酸氢钙溶液中加少量烧碱 Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| D. | 向酸性FeSO4溶液中加H2O2溶液 2Fe2++H2O2+2H+═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类物质都有甜味,有甜味的物质都是糖类物质 | |
| B. | 蛋白质水解产物氨基酸可以合成人体所需蛋白质 | |
| C. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| D. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子不一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 最高价含氧酸一定具有强氧化性 | |
| D. | 金属阳离子被还原一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | B. | c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | ||
| C. | c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) | D. | c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
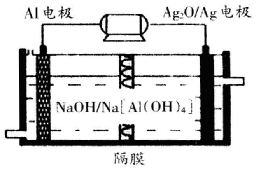 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
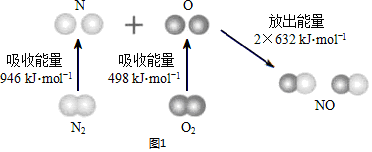
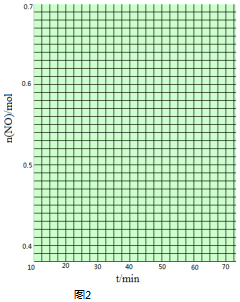

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
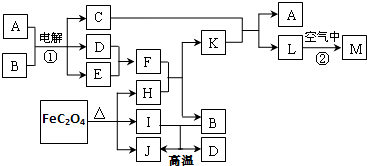
 ,下图从A晶体结构图中分割出来的部分结构图,试判断符合A晶体结构图的是AD.
,下图从A晶体结构图中分割出来的部分结构图,试判断符合A晶体结构图的是AD.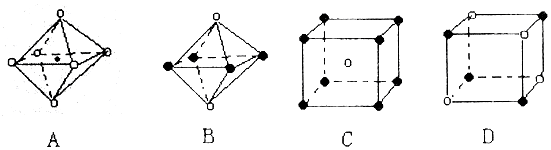
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com