
| A. | ①④ | B. | ①②③ | C. | ②③⑤ | D. | ③⑤ |
分析 二氧化硫具有漂白性,能使品红溶液褪色;二氧化硫能与具有氧化性的物质发生氧化还原反应;二氧化硫为酸性氧化物,能与碱反应,以此来解答.
解答 解:①品红溶液褪色,体现二氧化硫的漂白性;
②酸性KMnO4溶液褪色,与二氧化硫发生氧化还原反应,体现其还原性;
③溴水褪色,与二氧化硫发生氧化还原反应,体现其还原性;
④滴有酚酞的NaOH溶液褪色,是因二氧化硫与碱反应,体现其酸性氧化物的性质;
⑤含I2的淀粉溶液褪色,与二氧化硫发生氧化还原反应,体现其还原性;
显然②③⑤实质相同,
故选C.
点评 本题考查二氧化硫的化学性质,为高频考点,侧重还原性和漂白性的考查,注意使溶液褪色不一定为漂白性,明确二氧化硫对品红溶液的漂白,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,0.02 mol•L-1的醋酸溶液与0.01 mol•L-1的醋酸溶液中的c(H+)之比小于2:1 | |
| B. | 相同温度下,0.1 mol•L-1 (NH4)2SO4溶液与0.1 mol•L-1NH4NO3溶液中c(NH4+)之比大于2:1 | |
| C. | 在0.1 mol•L-1NaOH溶液中逐滴加入0.1 mol•L-1CH3COOH溶液,当溶液pH=7时,加入CH3COOH溶液的体积与NaOH溶液的体积比小于2:1 | |
| D. | 40℃时,pH=7的(NH4)2SO4与NH3•H2O的混合溶液中c(NH4+)与c(SO42-)之比小于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为负极,Y为正极 | |
| B. | 该电池工作时,X极附近溶液的碱性增强 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 工作一段时间后,KOH的物质的量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 | |
| B. | 检验酒精中的少量水:向酒精中加入足量生石灰 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. |  证明溴乙烷与NaOH醇溶液共热生成乙烯:用如右图所示的实验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
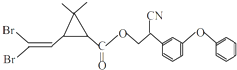 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述正确的是( )| A. | 属于芳香烃 | B. | 属于卤代烃 | ||
| C. | 在酸性条件下不水解 | D. | 在一定条件下可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
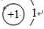 ,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H
,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H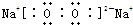 ,其中含有的化学键类型是离子键和共价键
,其中含有的化学键类型是离子键和共价键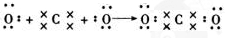 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
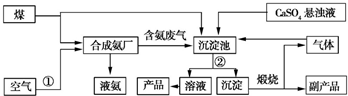
 2NH3.
2NH3. CaCO3↓+(NH4)2SO4.
CaCO3↓+(NH4)2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
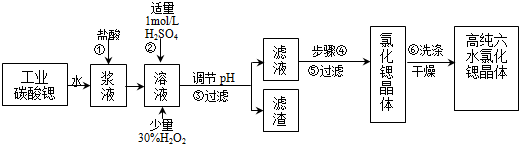
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com