
| A. | NH3+HCl═NH4Cl | B. | H2S+Na2S═2NaHS | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | D. | CO2+NaOH═NaHCO3 |
分析 电解质是指:该物质是化合物,溶于水溶液中或在熔融状态下就能够导电,是自身电离.酸、碱、盐都是电解质,在水溶液中和在熔融状态下两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质,据此即可解答.
解答 解:A.氨气常温下为气态只存在氨气分子不导电,NH3的水溶液能导电是氨气和水反应生成一水合氨,氨气本身不能电离出离子,属于非电解质,故A错误;
B.H2S、Na2S、NaHS在水溶液中都能电离出自由移动的离子,都是电解质,故B正确;
C.氧气是单质,电解质必须是化合物;二氧化碳的水溶液能导电,但本身不电离,则属于非电解质,故C错误;
D.二氧化碳的水溶液能导电,但本身不电离,则属于非电解质,故D错误.
故选B.
点评 本题主要考查电解质的概念,注意电解质和非电解质都必须是化合物,电解质能导电是溶于水溶液中或在熔融状态下自身电离,单质和混合物既不是电解质也不是非电解质,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液与Ba(OH)2溶液:NH4++HCO3-+Ba2++2OH-=NH3•H2O+BaCO3↓+H2O | |
| B. | FeBr2溶液中通入氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 苏打溶液与稀盐酸混合:HCO3-+H+=CO2↑+H2O | |
| D. | 向澄清石灰水中通入过量CO2:OH-+CO2=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/LCH3COOH溶液中含有0.1NA个氢离子 | |
| B. | 25℃是PH=13的Ba(OH)2溶液中含有0.1NA个OH- | |
| C. | 8.4gNaHCO3固体中含有0.1NA 个CO32- | |
| D. | 25℃,PH=11的Na2CO3溶液1L中由水电离出的H+的数目为10-3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 500 | 1000 | 1500 |
| n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
| A. | 平衡不移动 | |
| B. | 重新达到平衡后,再充入的M转化率小于50% | |
| C. | 重新达到平衡后,Y的平均反应速率与原平衡相等 | |
| D. | 重新达到平衡后,用X表示的v(正)比原平衡大 | |
| E. | 重新达到平衡后,混合气体中Y的体积分数增大 | |
| F. | 重新达到平衡后,M的物质的量浓度是原平衡的1.5倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1molK2SO4、0.1molNaCl、0.05molMgCl2溶于水制成100mL溶液 | |
| B. | 将0.05molK2SO4、0.1molNaCl、0.05molMgCl2溶于水制成100mL溶液 | |
| C. | 将0.1molK2SO4、0.05molNaCl、0.05molMgCl2溶于水制成100mL溶液 | |
| D. | 加入0.05molK2SO4、0.05molNaCl、0.1molMgCl2溶于水制成100mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
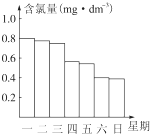 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com