
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。

实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
【答案】C
【解析】
实验Ⅰ.向①的Na2S溶液中持续通入CO2至过量,②中产生黑色沉淀,溶液的pH降低,说明生成了硫化氢气体,同时生成了硫酸;③中产生白色浑浊,该浑浊遇酸冒气泡,说明二氧化碳过量,被氢氧化钙溶液吸收生成了碳酸钙沉淀;
实验Ⅱ. 向盛有NaHCO3溶液的①中持续通入H2S气体至过量,②中产生黑色沉淀,溶液的pH降低,是因为过量的硫化氢气体与硫酸铜溶液反应生成了CuS黑色沉淀,同时生成了硫酸;③中产生白色浑浊,该浑浊遇酸冒气泡,说明反应生成了二氧化碳,被氢氧化钙溶液吸收生成了碳酸钙沉淀;据此分析解答。
A. 根据上述分析,③中白色浑浊是CaCO3,不可能是CaS,因为CaS遇水完全水解,故A正确;
B. ②中反应生成的硫化氢或过量的硫化氢与硫酸铜反应, H2S+Cu2+ = CuS↓+2H+,使得溶液的pH降低,故B正确;
C. CO2过量反应生成2HCO3,发生的反应是:2CO2+2H2O+ S2=2HCO3+ H2S,故C错误;
D. 根据实验Ⅰ、Ⅱ中现象:Ⅰ中通二氧化碳有H2S生成,Ⅱ中通H2S有二氧化碳生成,不能比较H2CO3和H2S酸性的强弱,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】燃料电池是燃料(如氢气、甲烷、一氧化碳等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法正确的是( )
A. 负极反应式:O2+2H2O+4e-![]() 4OH-
4OH-
B. 负极反应式:CH4+8OH--8e-![]() CO2+6H2O
CO2+6H2O
C. 随着放电的进行,溶液中氢氧根离子的浓度不变
D. 放电时溶液中的阴离子向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,互为同分异构体的是 ( )
A. 与
与
B. 与CH3CH2CH2CH2Cl
与CH3CH2CH2CH2Cl
C.CH4与CH3CH3
D.CH3CH(CH3)CH2CH2CH3与CH3CH2CH2CH(CH3)CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X) < Mr(Y)= 0.5Mr(Z),下列说法正确的是()
A.原子数目相等的三种气体,质量最大的是Z
B.相同条件下,同质量的三种气体,气体密度最小的是X
C.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D.同温下,体积相同的两容器分别充2gY气体和1gZ气体,则其压强比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
A. 加水,平衡向右移动,溶液中氢离子浓度增大
B. 通入过量SO2气体,平衡向左移动,溶液pH增大
C. 滴加新制氯水,平衡向左移动,溶液pH减小
D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,相同体积的0.5mol·L-1的下列四种溶液:①KCl溶液、②FeCl3溶液、③HF溶液、④Na2CO3溶液,其中所含阳离子数由多到少的顺序是( )
A. ④>①=②>③ B. ①>④>②>③ C. ④>①>③>② D. ④>②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学测定盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100![]() 0.10
0.10![]() 标准溶液。
标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)→洗涤(并将洗涤液移入容量瓶) →__________ →__________ →__________→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__________![]() 氢氧化钠固体所需仪器有:天平(带砝码、镊子)、__________、__________。
氢氧化钠固体所需仪器有:天平(带砝码、镊子)、__________、__________。
(2)取20.00 ![]() 待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的
待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的![]() 标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
实验编号 |
| 滴定完成时, | 待测盐酸的体积/ |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
① 滴定达到终点的标志是__________。
② 根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)。
③ 排除碱式滴定管中气的方法应采用如图所示操作中的__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有__________(填字母序号)。
A. 滴定终点读数时俯视
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 称量的![]() 固体中混有
固体中混有![]() 固体
固体
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所给信息,得出的结论正确的是
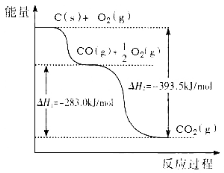
A.48g碳完全燃烧放出热量为1574 kJ/mol
B.2C(s)+O2(g)![]() 2CO(g) △H=-221.0kJ/mol
2CO(g) △H=-221.0kJ/mol
C.2CO2(g)![]() 2CO(g)+O2(g) △H=+283.0kJ/mol
2CO(g)+O2(g) △H=+283.0kJ/mol
D.C(s)+O2(g)![]() CO2(s) △H=-393.5kJ/mol
CO2(s) △H=-393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰元素的化合物在多个领域中均有重要应用。
(1)Mn2+基态核外电子排布式为________,SO42-中S原子轨道的杂化类型为________。
(2)二价锰的3种离子化合物的熔点如下表:
物质 | MnCl2 | MnS | MnO |
熔点 | 650℃ | 1610℃ | 2800℃ |
上表3种物质中晶格能最大的是________。
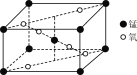
(3)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为________。
(4)在化合物K3[Mn(CN)6]中,微粒之间存在的作用力有________(填字母)。
a. 离子键 b. 共价键 c. 配位键 d. 氢键
(5)制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4∶1的物质的量之比配料,球磨3~5 h,然后升温,高温加热,保温24 h,冷却至室温。写出该反应的化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com