
| 1 | 2 |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
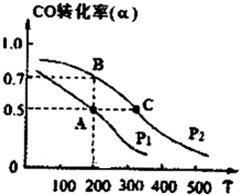 (2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.
(2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)美国“阿特兰蒂斯号”航天飞机与2009年5月11日升空修复含勃望远镜,它使用的燃料是液氢和液氧.已知下列热化学方程式:
(1)美国“阿特兰蒂斯号”航天飞机与2009年5月11日升空修复含勃望远镜,它使用的燃料是液氢和液氧.已知下列热化学方程式:| 1 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com