
【题目】25 ℃、101kPa下充分燃烧一定量乙烷(C2H6)气体放出的热量为Q kJ,用5 mol/L的KOH溶液100 mL完全吸收生成的CO2,并与之生成正盐,则乙烷的燃烧热的数值是
A.16Q B.8Q C.4Q D.2Q
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在25度时,在0.01mol·L-1的盐酸溶液中,水电离出的H+浓度是
A.5×10-13mol·L-1 B.0.02mol·L-1
C.1×10-7mol·L-1 D.1×10-12mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. C60与碳纳米管互为同素异形体
B. 最简式为CH3的有机物没有同分异构体
C. CH3C(CH3)2CH2CH3名称为2,2二甲基丁烷
D. 核外电子总数和质子数均相同的微粒必为同种粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO和CO2组成的混合气体,密度是相同条件下氢气密度的18倍,则该混合气体中CO和CO2的体积比为 ( )
A.1:1 B.1:2 C.2:1 D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”。某学校化学科研小组现对此味精中NaCl的含量进行测定。
查阅资料:资料表明,谷氨酸钠的存在不影响NaCl含量的测定。该小组同学设计的实验方案如图所示:
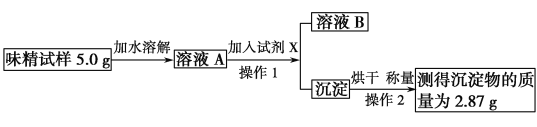
根据上述实验步骤回答下列有关问题:
(1)操作1所需要的玻璃仪器有____________;
(2)用简明扼要的语言描述操作2的过程: ;
(3)加水溶解所得溶液A为50 mL,则溶液A中NaCl的物质的量浓度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 向鸡蛋清的溶液中加入浓的硫酸钠溶液或福尔马林,蛋白质的性质发生改变并凝聚
B. 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,上层析出甘油
C. 氨基酸为高分子化合物,种类较多,分子中都含有—COOH和—NH2
D. 淀粉、纤维素、麦芽糖在一定条件下可和水作用转化为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,金属与硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与足量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
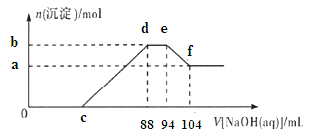
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.b点与a点的差值为0.05 mol
C.c点对应NaOH溶液的体积为40 mL
D.样品中铝粉和铁粉的物质的量之比为10:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。其中正确的操作顺序是 。
A①④②⑤③ B④①②⑤③ C②⑤④①③ D⑤②④①③ E①②⑤④③
II.实验室里需要纯净的氯化钠溶液,现只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案:
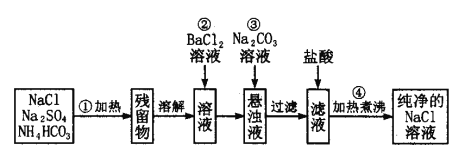
(1)操作①中发生的化学反应方程式为:NH4HCO3![]() NH3↑+CO2↑+H2O↑
NH3↑+CO2↑+H2O↑
则可选择________容器进行加热(选填:试管、量筒、容量瓶、分液漏斗)
(2)操作②反应的化学反应方程式为: ,能否用硝酸钡溶液代替氯化钡 (填“能”或“不能”)原因是: ;
(3)为了达到实验目的,进行操作②后,如何判断溶液中SO42-已除尽,其方法有_________。
A.静置,向上层清液中滴加硫酸钠,若有沉淀生成,则说明原溶液中的SO42-已除尽
B.静置,取上层清液于试管中,滴加硫酸钠,若有沉淀生成,则说明原溶液中的SO42-已除尽
C.静置,向上层清液中滴加氯化钡溶液,若无沉淀生成,则说明原溶液中的SO42-已除尽
D.静置,取上层清液于试管中,滴加氯化钡溶液,若无沉淀生成,则说明原溶液中的SO42-已除尽
E.静置,取上层清液于试管中,滴加硝酸银溶液,若有沉淀生成,则说明原溶液中的SO42-已除尽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,A物质的量浓度变为原来的60%,则ab(填“>、=、<”),简述其理由。
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,A物质的量浓度变为原来的60%,则ab(填“>、=、<”),简述其理由。
(2)在恒温时,在固定容器中充入N2O4,发生反应N2O4(g)![]() 2NO2(g),在达到平衡后,若又向容器中充入一定量的N2O4,当达到新平衡时,反应体系中NO2(g)的体积分数将(增大、减小、不变)。
2NO2(g),在达到平衡后,若又向容器中充入一定量的N2O4,当达到新平衡时,反应体系中NO2(g)的体积分数将(增大、减小、不变)。
(3)在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其反应化学平衡常数和T的关系如下表所示:
CO(g)+H2O(g),其反应化学平衡常数和T的关系如下表所示:
T/℃ | 700 | 800 | 830 | 1000 | 1200[来 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
A.对于CO(g)+H2O(g)![]() CO2(g)+H2(g)此平衡体系,升温平衡向移动。
CO2(g)+H2(g)此平衡体系,升温平衡向移动。
B.达到平衡后,若压缩容器的体积,正逆反应速率的变化是。
C.对原平衡,在t0时升高温度对化学反应速率产生影响,请在下图中绘出速率变化图:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com