
分析 (1)既能与盐酸又能与烧碱溶液反应的有两性氧化物、两性氢氧化物、弱酸的酸式盐、弱酸弱碱盐等;
(2)根据④呈中性结合电荷守恒判断;
(3)已知溶液⑤呈碱性,④呈中性,说明醋酸酸性比碳酸强.
解答 解:(1)HCO3-既不与酸共存,也不与碱共存;NH4+不与碱共存,CH3COONH4为弱酸弱碱盐,故既能与盐酸反应,又能与烧碱反应的电解质有②④⑤,
故答案为:②④⑤;
(2))④呈中性c(H+)=c(OH-),又电荷守恒为c(H+)+c(NH4+)=c(CH3COO-)+c(OH-),所以离子浓度由大到小的顺序c(CH3COO-)=c(NH4+)>c(H+)=c(OH-),
故答案为:c(CH3COO-)=c(NH4+)>c(H+)=c(OH-);
(3)④呈中性,CH3COONH4是弱酸弱碱盐,溶液呈中性,说明CH3COO-和NH4+水解程度相同,但H2CO3酸性弱于CH3COOH,HCO3-的水解程度大于CH3COO-,所以NH4HCO3溶液pH>7,
故答案为:HCO3-的水解程度比CH3COO-大或CH3COOH酸性比H2CO3强.
点评 本题考查电解质、盐类水解,综合考查学生化学知识的应用能力和分析问题的能力,为高考常见题型,题目难度不大,注意把握盐类水解和弱电解质的电离特点.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
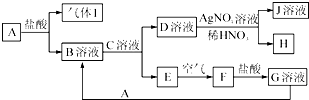 已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色,各物质之间的转化关系如图所示.
已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色,各物质之间的转化关系如图所示. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba (OH)2溶液与过量NaHCO3溶液混合离子方程式:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| B. | Na+的结构示意图: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 氢氧化铁的电离方程式:Fe(OH)3═Fe3++3OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2<Q1<Q | D. | Q=Q1>Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| ① | 物质微粒数 | 阿伏加德罗常数 |
| ② | 标况下气体摩尔体积 | 标况下气体体积 |
| ③ | 溶剂的体积 | 溶质的物质的量浓度 |
| ④ | 溶液中溶质的质量分数 | 溶液的质量 |
| ⑤ | 非标况下物质的质量 | 物质的摩尔质量 |
| A. | ③ | B. | ③④ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用干燥的pH试纸检验CO2 | |
| B. | 用干燥的红色石蕊试纸检验NH3 | |
| C. | SO2能使湿润的品红试纸褪色 | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验方法 | 观察到的现象 |
| 步骤1 | ||
| 步骤2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com