
| A. | ①② | B. | ③④ | C. | ①③④ | D. | 全部 |
科目:高中化学 来源: 题型:实验题
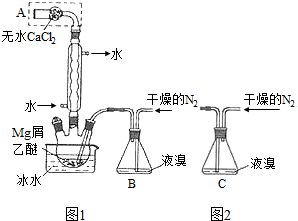
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮藏罐贮运浓硫酸 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 次氯酸具有强氧化性,因此氯气可用于自来水的杀菌消毒 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| B. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| C. | 溴苯(溴单质):加NaOH溶液振荡,分液,弃水层 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
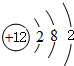 ,⑧
,⑧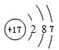
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
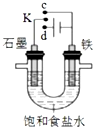
| A. | 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O | |
| B. | 若K与c连接,则溶液中的Na+向铁电极移动 | |
| C. | 若K与d连接,铁电极的电极反应为:2H++2e-═H2↑ | |
| D. | 若K与d连接,一段时间后,加适量稀盐酸可使电解质溶液复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H与3H互为同位素 | B. | 金刚石与石墨互为同素异形体 | ||
| C. | 3O2$\frac{\underline{\;放电\;}}{\;}$2O3是物理变化 | D. | 乙醇与二甲醚互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com