
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
B. 4.6 g NO2和N2O4混合物中含氧原子数为0.3 NA
C. 标准状况下,6.72 L NO2与水反应,转移电子数为0.3 NA
D. 0.1 mol/L NaHCO3溶液中,HCO3-、H2CO3和CO32-总数为0.1NA
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础
有机物Ⅰ广泛应用在航空、激光等领城,Ⅰ的一种合成路线如下:
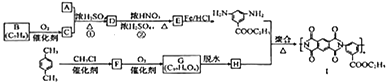
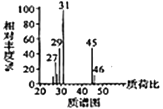
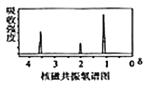
已知:①有机物A的质谱图与核磁共振氢谱图如下:
①2RCOOH![]()
![]() +H2O
+H2O
②
回答下列问题:
(1)A的化学名称是________,C中含氧官能团的名称是________。
(2)②的反应类型为_________,Ⅰ的分子式为_________。
(3)①的反应方程式为_______________________________________。
(4)F的结构简式是______________。
(5)同时满足下列条件的G的同分异构体共有________种(不含立体结构),写出其中的一种结构式:__________。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
(6)写出用间二甲苯和甲醇为原料制备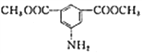 的合成路线:________________(其他试剂任选)。
的合成路线:________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2、NH4HSO4用途广泛。请回答下列问题:
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填数值)。
(2)80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是________________________ (用离子方程式并结合文字叙述回答)。
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为__________________。
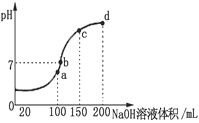
(4)浓度均为0.1 mol·L-1 NH4Al(SO4)2溶液和NH4HSO4溶液,其中______溶液c(NH4+)大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3Cl2+6KOH![]() KClO3+5KCl+3H2O的反应中,下列说法不正确的是 ( )
KClO3+5KCl+3H2O的反应中,下列说法不正确的是 ( )
A. Cl2是氧化剂,KOH是还原剂
B. KCl是还原产物,KClO3是氧化产物
C. 反应中每消耗3 mol Cl2,转移电子数为5NA
D. 被还原的氯气的物质的量是被氧化的氯气的物质的量的5倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定盐酸、碳酸、硅酸的酸性强弱,设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。(提示:检验酸的酸性强弱可用强酸制取弱酸)

(1)锥形瓶中装某可溶性正盐,分液漏斗中所盛试剂应为________。
(2)装置B中所盛试剂是________________________________________,其作用是_____________。
(3)装置C中所盛试剂是___________________________________________,
C中反应的离子方程式是_________________________________________________。
(4)由此得到的结论是酸性:________>________>________。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是
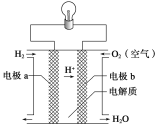
A. 该电池中电极a是正极
B. 外电路中电子由电极b通过导线流向电极a
C. 该电池的正极反应为O2+4H++4e- = 2H2O
D. 该电池的总反应:2H2+O2 = 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将反应2Fe3++2I-=2Fe2++I2设计成下图所示的原电池:

实验步骤及现象如下:
①闭合开关,指针发生偏转,随后电流计读数逐渐变小,当读数变为零时,打开开关;
②取少许甲烧杯中溶液,滴入3~4滴淀粉溶液,溶液显蓝色;
③取少许乙烧杯中溶液,滴入3~4滴KSCN溶液,溶液显血红色;
④向乙烧杯中加入少量FeCl2固体,再次闭合开关,指针向左偏转(最后读数变为零)。
【查阅资料】灵敏电流计指针总是偏向电源正极;原电池中存在内阻,会影响反应进程。
请回答:
(1)步骤①中,开始时指针向_____(填“左"或“右”)偏转,甲烧杯中发生的电极反应式____________________。
(2)经步骤①后,乙烧杯溶液中新增金属阳离子____________(填离子符号)。
(3)步骤④中指针向左偏转,乙烧杯中发生的电极反应式______________________。
(4)要证明2Fe3++2I-![]() 2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________(填序号)。
2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表。
序号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________________(用离子方程式表示),在该溶液中下列关系式错误的是________________(填标号)。
a.c(Na+)+c(H+)=c(OH-)+c(A-) b.c(Na+)=c(HA)+c(A-)
c.c(HA)+c(H+)=c(OH-) d.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c______0.2(填“>”“<”或“=”,下同),混合溶液中:c(A-)_______c(Na+)。
(3)从③组实验结果分析,说明HA的电离程度_____NaA的水解程度(填“>”“<”或“=”),离子浓度由大到小的顺序是_______________________________。
Ⅱ.室温下,若将0.1 molL-1盐酸滴入20mL0.1 molL-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示:

(1)NH3·H2O的电离方程式是_______________________________。
(2)b点所示溶液中的溶质是_______________________________。
(3)c点所示溶液中,离子浓度从大到小的关系为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com