
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。现有含FeClx杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:

请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是__________。
(3)本实验用加碱沉淀的目的是否能达到?__________。原因是__________。
(4)加氧化剂的目的为__________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________。如何操作?__________。·
【答案】C CuO或Cu(OH)2或CuCO3 不能 因加碱的同时也会使Cu2+生成Cu(OH)2沉淀 将Fe2+氧化成Fe3+,便于生成沉淀而与Cu2+分离 不能 应在HCl气流中蒸发
【解析】
加入氧化剂X的目的是把亚铁离子氧化,根据除杂原则,不能引入新的杂质;加入试剂Y的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体,
(1)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质;
(2)物质Y的作用是调节溶液的pH,据此来选择合适的试剂;
(3)本实验用加碱沉淀的目的不能达到,因加碱的同时也会使Cu2+生成Cu(OH)2沉淀 ;
(4)加入氧化剂,将Fe2+氧化为Fe3+;
(5)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发).
(1)根据题意,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,故选C;
(2)调节pH至3.7,使Fe3+全部沉淀,所以Y最好为CuO或Cu(OH)2或CuCO3 ;
(3)本实验用加碱沉淀的目的不能达到,因加碱的同时也会使Cu2+生成Cu(OH)2沉淀 ;
(4)Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开,根据题干提供信息可知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去;
(5)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发).所以应在HCl气氛中采用浓缩后冷却结晶的方法,以得到CuCl2·2H2O的晶体。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将4 molA气体和2 molB气体在 2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)=2C(g)若经2 s后测得C的浓度为0.6 mol/L,现有下列几种说法
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
其中正确的是
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 第Ⅰ![]() 族元素的金属性比第Ⅱ
族元素的金属性比第Ⅱ![]() 族元素的金属性强
族元素的金属性强
B. 第Ⅵ![]() 族元素的简单气态氢化物中,稳定性最强的其沸点也最高
族元素的简单气态氢化物中,稳定性最强的其沸点也最高
C. 同周期非金属元素的氧化物对应的水化物的酸性从左到右依次增强
D. 第二周期元素随族序数的递增,其最高化合价也递增
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01mol·L1 KMnO4溶液,几滴浓H2SO4 | 2mL0.3mol·L1H2C2O4 溶液 | 2 | 褪为无色 |
b | 4mL0.01mol·L1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:_____________。
(2)实验I试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为:________。
(3)瑛瑛和超超查阅资料,实验I试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验III | 实验IV | ||
实验操作 |
|
|
|
实验现象 | 6 min后固体完全溶解,溶液橙色变浅,温度不变 | 6 min后固体未溶解,溶液颜色无明显变化 | 6 min后固体未溶解,溶液颜色无明显变化 |
实验IV的目的是:_______________________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72- 浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i.MnO2与H2C2O4反应生成了Mn2+。
过程ii.__________________________________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001molMnO2加入到6mL____________中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到_______________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案是________。
(5)综合以上实验可知,草酸发生氧化反应的速率与__________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() X表示原子:
X表示原子:
①AXn+共有x个电子,则该阳离子的中子数N=____。
②12C16O2分子中的中子数N=______。
③A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为_____。
(2)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是_____。
(3)已知某粒子的结构示意图为![]()
试回答:①当x-y=10时,该粒子为___(填“原子”、“阳离子”或“阴离子”)。
②写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是
A. 辛酸的同分异构体(CH3)3CCH (CH3) CH2COOH的名称为 2,2,3-三甲基戊酸
B. 辛酸的羧酸类同分异构体中,含有3个“一CH3”结构,且存在乙基支链的共有7种(不考虑立体异构)
C. 辛酸的同分异构体中能水解生成相对分子质量为74的有机物的共有8种(不考虑立体异构)
D. 正辛酸常温下呈液态,而软脂酸常温下呈固态,故二者不符合同一通式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A——F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 | A | B | C |
结构简式 |
|
|
|
化合物 | D | E | F |
结构简式 |
|
|
|
(1)化合物A属于________类(按官能团种类分类)
(2)化合物B在一定条件下,可以与NaOH溶液发生反应,写出化合物B 与足量NaOH反应的化学方程式_____________。
(3)化合物C与D在一定条件下发生如图转化得到高分子化合物Z,部分产物已略去。

反应③中D与H2按物质的量1:1反应生成Y,则 生成Z的方程式为__________。
(4)化合物D与银氨溶液反应的化学方程式____________(有机物用结构简式表示):。
(5)写出符合下列条件的E的同分异构体的结构简式:_________。
A.苯环上只有一个取代基
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(6)化合物F是合成“克矽平”(一种治疗矽肺病的药物)的原料之一,其合成路线如下:(说明:克矽平中氮氧键是一种特殊的共价键;反应均在一定条件下进行。)
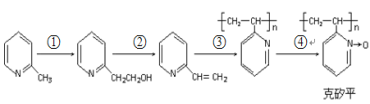
a.反应①是原子利用率100%的反应,则该反应的化学方程式为_____________;
b.上述转化关系中没有涉及的反应类型是(填代号)___________。
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
Ⅰ.汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应①2NO(g)+ 2CO(g) N2(g) + 2CO2(g) ΔH1。
(1)已知:反应②N2(g)+O2(g) 2NO(g) ΔH2= +180.5 kJ·mol-1,CO的燃烧热为283.0 kJ·mol-1,则ΔH1=____。
(2)在密闭容器中充入5molCO和4molNO,发生上述反应①,图1为平衡时NO的体积分数与温度、压强的关系。
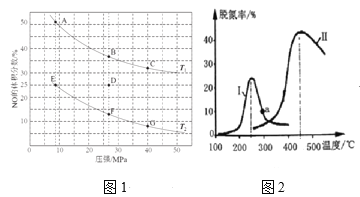
①温度:T1____T2(填“<”或“>”) 。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。若低于200℃,图2中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为______;a点_____(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由______。
II.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g) (快反应)
第二步I(g)+N2O(g) → N2(g)+IO(g) (慢反应)
第三步IO(g)+N2O(g) → N2(g)+O2(g)+I2(g) (快反应)
实验表明,含碘时N2O分解速率方程v = k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是____。
A.I2浓度与N2O分解速无关 B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的中间产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com