
| A. | 向沸水中滴加饱和氯化铁溶液制备胶体,用可见光束照射,产生丁达尔效应 | |
| B. | 常温下,向0.10mol•L-1NaHCO3溶液,滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出,说明加入CaCl2促进了HCO3-的水解 | |
| C. | 利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定 | |
| D. | 向浓度均为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2] |
分析 A.该操作过程中产生了氢氧化铁胶体,胶体具有丁达尔效应;
B.加入氯化钙后促进了碳酸氢根离子的电离;
C.中和热的测定中需要的实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计;
D.溶度积常数小的物质先产生沉淀.
解答 解:A.向沸水中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体,而胶体具有丁达尔效应,故A正确;
B.白色沉淀应为CaCO3,HCO3-?H++CO32-,Ca2++CO32-=CaCO3↓,促进了HCO3-电离,不是促进了水解,故B错误;
C.中和热的测定中需要的实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计,温度计测量溶液温度、环形玻璃搅拌棒搅拌溶液使溶液温度均匀,故C正确;
D.先出现蓝色沉淀,即Cu(OH)2溶液,故KSP[Cu(OH)2]<KSP[Mg(OH)2],故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及中和热测定、溶度积常数大小比较、胶体制备与性质等知识点,明确物质性质及实验原理是解本题关键,试题培养了学生的分析能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 13 | C. | 3 | D. | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛 | B. | 3-甲基丁醛 | C. | 已醛 | D. | 丁醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H10O的醇,能在铜催化和加热条件下被氧气氧化为醛的同分异构体共有4种 | |
| B. | 2-氯丁烷与NaOH乙醇的溶液共热的反应产物中一定不存在同分异构体 | |
| C. | 3-甲基-3-乙基戊烷的一氯代物有5种 | |
| D. | 分子式为C7H8O的有机物,能与氯化铁溶液发生显色反应的同分异构体共有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 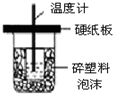 如图装置用于中和热的测定 | |
| B. | 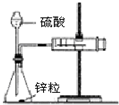 如图装置用于测定氢气的反应速率(单位mL/s) | |
| C. | 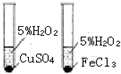 如图装置用于研究催化剂Cu2+和Fe3+对反应速率的影响 | |
| D. | 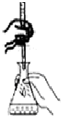 如图装置用于已知浓度的高锰酸钾溶液测定未知浓度的草酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
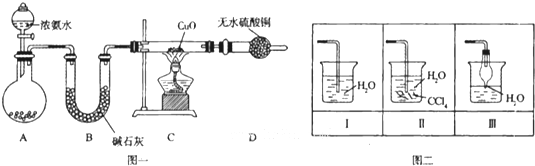
 有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.
有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com