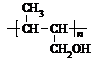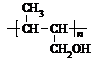(2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题.
(1)若开始时开关K与a连接,则B极的电极反应式为
Fe-2e=Fe2+
Fe-2e=Fe2+
.
(2)若开始时开关K与b连接,则B极的电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
,总反应的离子方程式为
,有关该实验的下列说法正确的是(填序号)
②
②
.
①溶液中Na
+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,设想用右图装置电解硫酸钾溶液来制取氢

气、氧气、硫酸和氢氧化钾.
①该电解槽的阳极反应式为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
.此时通过阴离子交换膜的离子数
小于
小于
(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从(填写“A”、“B”、“C”、“D”)
D
D
出口导出.
③通电开始后,阴极附近溶液pH会增大,请简述原因
H+放电,促进水的电离,OH-浓度增大
H+放电,促进水的电离,OH-浓度增大
.
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.

 (2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题.
(2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题. 气、氧气、硫酸和氢氧化钾.
气、氧气、硫酸和氢氧化钾.

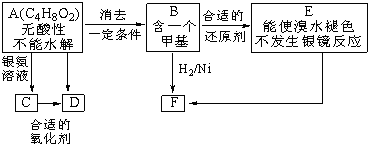
 (注:R、R?为烃基)
(注:R、R?为烃基)