
| A、②>①>④>③ |
| B、③>④>①>② |
| C、③>④>②>① |
| D、④>③>①>② |


科目:高中化学 来源: 题型:
| A、自来水生产中应尽量用明矾净化、消毒 |
| B、高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用 |
| C、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 |
| D、绿色化学的核心是利用化学反应原理治理环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、节省化石燃料 |
| B、减少有害气体的排放 |
| C、有利于转化过剩的粮食 |
| D、提高每千克燃料燃烧放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含有0.1 mol/L Ca2+的溶液中:Na+、K+、ClO-、Cl- |
| B、在pH为7的溶液中:Ag+、Mg2+、SO42-、Cl- |
| C、在澄清透明的无色溶液中:Al3+、Cu2+、HCO3-、NO3- |
| D、c(OH-)=1×10-3mol/L的溶液中:K+、SO42-、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
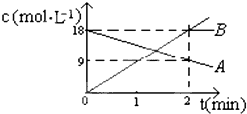 反应:A═2B中,A、B的浓度变化如图所示.则2min以内的平均反应的速率为( )
反应:A═2B中,A、B的浓度变化如图所示.则2min以内的平均反应的速率为( )| A、vA=9 mol/(L?min) |
| B、vA=4.5 mol?L?min |
| C、vB=18 mol/(L?min) |
| D、vB=9mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸滴人氨水中:H++OH-═H2O | ||
B、过量的SO2通人NaOH溶液中:SO2+20H-=SO
| ||
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++2H2O | ||
| D、硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+、Iˉ、Cl2 |
| B、Na+、K+、CO32ˉ、OHˉ |
| C、NH4+、H+、NO3ˉ、HCO3ˉ |
| D、K+、Al3+、SO42ˉ、NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
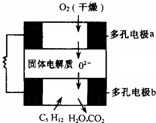 设计出燃料电池使汽油(设其成分为C5H12)氧化直接产生电流是21世纪最富有挑战性的课题之一.最近有人设计了一种固体燃料电池,固体氧化铝--氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如右图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
设计出燃料电池使汽油(设其成分为C5H12)氧化直接产生电流是21世纪最富有挑战性的课题之一.最近有人设计了一种固体燃料电池,固体氧化铝--氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如右图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A、b极为电池的正极 |
| B、b极对应的电极反应式为:C5H12+16O2--32e-=5CO2+6H2O |
| C、该电池的总反应方程式为:C5H12+8O2+10OH-=5CO32-+11H2O |
| D、汽油燃料电池最大的技术障碍是氧化反应不完全,产生炭粒堵塞电极的气体通道,从而使输电效能减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c H+ |
| c CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com