
| A、氮气的转化率增大 |
| B、氢气的转化率不变 |
| C、氨气在平衡混合气体中的含量一定增大 |
| D、氨气在平衡混合气体中的物质的量增多 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜溶于FeCl3溶液:Cu+Fe3+=Cu2++Fe2+ |
| B、NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| C、次氯酸钠溶液中滴入浓盐酸产生氯气:ClO-+Cl-+2H+=Cl2↑+H2O |
| D、碳酸氢钙溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,有关说法正确的是( )| A、电池总反应为:4NH3+3O2=2N2+6H2O |
| B、电池工作时,OH-向正极移动 |
| C、电极2发生的电极反应为:O2+4H++4e-=2H2O |
| D、电流由电极1经外电路流向电极2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)=(2)=(3) |
| B、(1)=(2)>(3) |
| C、(1)>(2)>(3) |
| D、(2)>(1)=(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
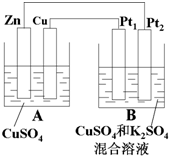 如图A、B两个装置,回答下列问题:
如图A、B两个装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、NH4+、Br-、OH- |
| B、Ag+、NO3-、Cl-、K+ |
| C、K+、Ba2+、OH-、SO42- |
| D、H+、NO3-、Fe2+、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com