
| A. | 电池工作时,锌失去电子,电解液内部OH-向负极移动 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
分析 根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,失电子,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),结合离子、电子移动来分析解答该题.
解答 解:A、根据总反应可知Zn失电子被氧化,为原电池的负极,电解质溶液中阴离子向负极移动,故A正确;
B、根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),故B正确;
C、原电池中,电子由负极经外电路流向正极,故C错误;
D、负极反应为Zn-2e-+2OH-═Zn(OH)2,外电路中每通过O.2mol电子,消耗的Zn的物质的量为0.1mol,质量为0.1mol×65g/mol=6.5g,故D正确.
故选C.
点评 本题考查化学电源的工作原理,题目难度不大,注意电极反应方程式的书写和判断,侧重于考查学生对基础知识的应用能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 放电时,OH-向负极方向移动 | |
| B. | 放电时,正极反应式为Zn+2OH--2e-═ZnO+H2O | |
| C. | 充电时,Zn发生氧化反应 | |
| D. | 充电时,阴极附近PH 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
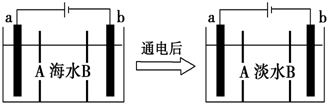
| A. | A膜是阳离子交换膜(只允许阳离子通过) | |
| B. | 通电后,海水中阴离子往b电极处运动 | |
| C. | 通电后,a电极的电极反应为4OH-4e-═O2↑+2H2O | |
| D. | 通电后,b电极上产生无色气体,溶液中出现少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,①不能(填“能”或“不能”)确定产物中铁元素的价态 |
| 步骤2: 取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫红色褪去或变浅,说明产物中含+2价铁元素,若KMnO4溶液不褪色或红色不变浅,说明产物中不含+2价铁元素 |
| 步骤3:③另取少量溶液,滴加KSCN溶液 | 若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
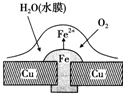
| A. | 正极的电极反应为:2H++2e-═H2↑ | |
| B. | 此过程中还涉及反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| C. | 此过程中铜并不被腐蚀 | |
| D. | 此过程中电子从Fe移向Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NO | N2 | CO2 | |
| 起始浓度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.04 | 0.03 | 0.03 |
 ,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).
,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| a转化为b | a转化为c | c转化为b | |
| A | NaOH | Na | CO2 |
| B | Na2CO3 | NaOH | HCl |
| C | NaHCO3 | NaOH | CO2 |
| D | NaHCO3 | Na | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com