
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3-[] | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5[] | 3×10-5 | 2×10-5 |
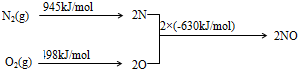
分析 (1)根据溶液中电荷守恒计算;
(2)①根据能量变化图计算反应热,反应热=吸收的能量-放出的能量,再根据热化学反应方程式的书写规则书写;
②NO被CO还原,则CO被NO氧化生成二氧化碳,据此写出反应方程式;
③如反应能自发进行,应满足△H-T•△S<0;
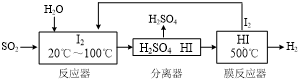
(3)①碘和二氧化硫反应生成硫酸和HI,类似于氯气和二氧化硫的反应;
②根据平衡移动的原理来分析;
③电池放电时,负极发生氧化反应,MH被氧化生成水和M;为避免爆炸,氧气在阴极上得电子发生还原反应.
解答 解:(1)溶液中电荷守恒:c(K+)+c(NH4+)++c(Na+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-),将表中数据带入可得c(H+)=1×10-4mol•L-1,pH值为4,
故答案为:4;
(2)①该反应中的反应热=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以其热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+183 kJ•moL-1,
故答案为:+183 kJ•moL-1;
②在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:2NO+2CO $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,
故答案为:2NO+2CO $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
③2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T•△S,G>0,不能实现,
故答案为:不能;该反应是熵减、焓增的反应,任何温度下均不能自发进行;
(3)①碘和二氧化硫反应生成硫酸和HI,反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②在膜分离器中发生反应:2HI?I2+H2,将H2分离出来有利于平衡向右移动,利于I2和H2的生成,
故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
③负极反应物MH失去电子,生成的H+在碱性条件下生成H2O,电解反应式为:MH-e-+OH-=H2O+M,阴极的电极反应有两个,第一阶段是充电时的反应式,阴极上电极反应式为M+H2O+e-═MH+OH-,第二阶段为吸收氧气的电解反应式,由题意知氧气在阴极上被还原,电解质溶液呈碱性可知氧气被还原为OH-,所以其电极反应式为2H2O+O2+4e-═4OH-,
故答案为:MH+OH--e-=H2O+M;4O2+4e-+2H2O=4OH-.
点评 本题较为综合,涉及化学反应方程式、离子方程式、热化学反应方程式、电极反应式的书写等知识点,注意反应热的计算方法,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色逐渐变浅 | |
| B. | 气态氢化物的稳定性逐渐增强 | |
| C. | 从F→I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱 | |
| D. | 单质的熔沸点逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
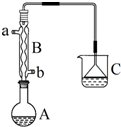 正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
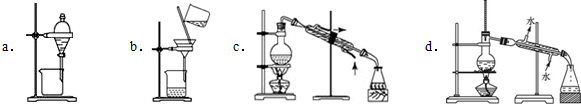
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数增大 | |
| D. | 通入CO2,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com