
| 1 |
| 2 |
| 1 |
| 2 |
| T/K | 673 | 773 | … |
| K | K1 | K2 | … |
| 1 |
| 2 |
| 1 |
| 2 |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、IA族元素的金属性一定比ⅡA族元素的金属性强 |
| B、ⅥA族中氢化物最稳定的元素,其最高价含氧酸的酸性也最强 |
| C、某一元素可能既显金属性,又显非金属性 |
| D、短周期中,同周期元素所形成的简单离子的半径,从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、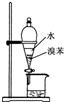 用如图所示装置分离出溴苯 |
B、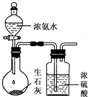 用如图所示装置制取干燥的氨气 |
C、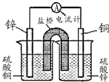 用如图设计成铜锌原电池装置 |
D、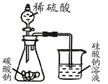 用如图证明氢化物稳定性SiH4>CH4>H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com