
| A、原混合气体的平均相对分子质量为30 |
| B、原混合气体的平均相对分子质量为28 |
| C、起始时,NH3与CO2的体积比为13:14 |
| D、起始时,NH3与CO2的体积比为14:15 |
| 13×17+14×44 |
| 13+14 |
| 14×17+15×44 |
| 14+15 |
| 13×17+14×44 |
| 13+14 |
| 14×17+15×44 |
| 14+15 |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
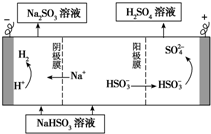 工业生产中用SO2为原料制取硫酸
工业生产中用SO2为原料制取硫酸查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸能与木炭反应,证明浓硝酸具有氧化性和酸性 |
| B、溴中溶有少量氯气,可用先加入少量溴化钠溶液再用酒精萃取的方法提纯 |
| C、高温下SiO2与Na2CO3生成Na2SiO3和CO2,证明硅酸酸性强于碳酸 |
| D、铵盐受热都能分解,但不一定都能生成氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加NaOH |
| B、加盐酸 |
| C、加NH4Cl |
| D、加同浓度氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:6 | B、6:1 |
| C、1:5 | D、5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| V2O5 |
| 500℃ |
| A、容器中SO2、O2、SO3共存 |
| B、SO2 与SO3的浓度相等 |
| C、反应容器中压强不随时间变化 |
| D、容器中SO2、O2、SO3的物质的量之比为2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、NO3-、SO42- |
| B、K+、Ba2+、Cl-、NO3- |
| C、Na+、Al3+、OH-、K+ |
| D、Na+、Cl-、K+、Ag+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com