
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
分析 (1)硅元素三个电子层,最外层4个电子,位于周期表中的第三周期第ⅣA;
A.原子晶体熔点高、性质稳定;
B.原子晶体熔点高、硬度大;
C.光导纤维的主要成分是二氧化硅;
D.普通玻璃中含有钠元素;
E.盐酸不能与硅反应;
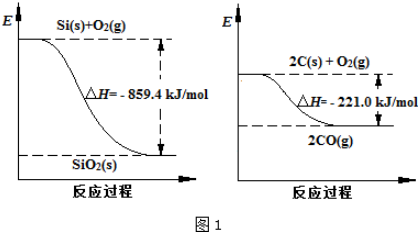
(2)根据两个反应过程能量变化图象可知:Si(s)+O2(s)═SiO2(s)△H=-859.4 kJ•mol-1,2C(s)+O2(s)═2CO(g)△H=-221.0 kJ•mol-1,用第二个方程式减去第一个方程式得出所需反应;
(3)C和Si最外层电子数相同,C原子半径小于Si,化学键的强弱分析判断稳定性;
(4)①根据各物质沸点的不同分离提纯物质,可用蒸馏(或分馏)法;
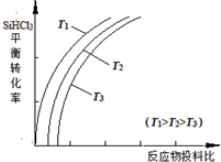
②a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是$\frac{n({H}_{2})}{n(SiHC{l}_{3})}$;
c.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,故实际生产中为提高SiHCl3的利用率,应适当升高温度;
③根据质量守恒定律,可确定产物中H元素不守恒,即添加H2,结合原子守恒配平书写.
解答 解:(1)硅元素三个电子层,最外层4个电子,位于周期表的3周期ⅣA族;
A.碳化硅属于原子晶体,化学性质稳定且熔点较高,但不可用于生产耐高温水泥,故A错误;
B.氮化硅陶瓷是新型无机非金属材料之一,氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承,故B正确;
C.光导纤维是高纯度的二氧化硅可用于制造高性能通讯材料,故C正确;
D.普通玻璃是由纯碱、石灰石和石英砂制成的,含有钠元素,在玻璃尖口点燃H2时出现黄色火焰,故D正确;
E.盐酸不与硅反应,硅和氢氟酸反应,采用的是氢氟酸为抛光液抛光单晶硅,故E错误;
故答案为:BCD;
(2)根据两个反应过程能量变化图象可知:Si(s)+O2(s)═SiO2(s)△H=-859.4 kJ•mol-1
2C(s)+O2(s)═2CO(g)△H=-221.0 kJ•mol-1,用第二个方程式减去第一个方程式得出所需反应,SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1,得到△H=+638.4 kJ•mol-1,
故答案为:+638.4 kJ•mol-1;
(3)硅烷的分解温度远低于甲烷,是因为C和Si最外层电子数相同,C原子半径小于Si,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷,
故答案为:C和Si最外层电子数相同,C原子半径小于Si;
(4)①根据各物质沸点的不同分离提纯物质,可用蒸馏(或分馏)法,故答案为:蒸馏(或分馏);
②a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大,故a正确;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是$\frac{n({H}_{2})}{n(SiHC{l}_{3})}$,故b错误;
c.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,故实际生产中为提高SiHCl3的利用率,应适当升高温度,故c正确;
故选ac;
③根据质量守恒定律,可确定产物中H元素不守恒,即添加H2,有SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑,
故答案为:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑.
点评 本题主要考查的是元素周期表的应用、盖斯定律应用、化学平衡常数和平衡移动等,题目难度中等,注意相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 活性炭、吸附剂 | B. | KMnO4、氧化剂 | C. | 氯化钠、干燥剂 | D. | 硅胶、干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| D. | 管右端浸有淀粉KI溶液的棉球颜色变化可判断氯气是否被碱液完全吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中Cl-、NO3-、Na+、SO32-可以大量存在 | |
| B. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| C. | 向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色,说明原溶液中有I- | |
| D. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32-+2I-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 C2H5OOCCH2CH2COOC2H5+2H2O.
C2H5OOCCH2CH2COOC2H5+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸制乙酸乙酯;苯的硝化反应 | |
| B. | 乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷 | |
| C. | 葡萄糖与新制氢氧化铜共热;蔗糖与稀硫酸共热 | |
| D. | 乙醇和氧气制乙醛;苯和氢气制环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

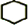 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$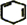 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com